
| A. | 1molH2O的质量为18g/mol | B. | CH4的摩尔质量为16g | ||
| C. | 1mol任何气体体积均为22.4L | D. | 0.5molSO2分子的质量为32g |
分析 A.质量的单位是g,摩尔质量的单位是g/mol;
B.摩尔质量的单位是g/mol,在数值上等于其相对分子质量;
C.气体摩尔体积受温度和压强影响;
D.根据m=nM计算质量.
解答 解:A.质量的单位是g,摩尔质量的单位是g/mol,1mol水的质量是18g,故A错误;
B.摩尔质量的单位是g/mol,在数值上等于其相对分子质量,甲烷的摩尔质量是16g/mol,故B错误;
C.气体摩尔体积受温度和压强影响,未指明温度和压强,无法计算气体体积,故C错误;
D.m=nM=0.5mol×64g/mol=32g,故D正确;
故选D.
点评 本题考查物质的量有关计算,为高频考点,侧重考查基本概念、基本计算,明确各个物理量单位、气体摩尔体积适用范围及适用条件是解本题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
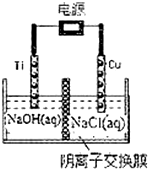 硝酸是一种重要的化工原料,工业上一般以氨气为原料来制备硝酸.请回答:
硝酸是一种重要的化工原料,工业上一般以氨气为原料来制备硝酸.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入稀氨水,平衡逆向移动,c(OH-)降低 | |
| B. | 向水中加入少量固体NaHSO4,c(H+)增大,KW不变 | |
| C. | 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)减小 | |
| D. | 将水加热,KW增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 配制溶液时,若加水超过容量瓶刻度线,应用胶头滴管将多余溶液吸出 | |
| C. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 | |
| D. | 用分液的方法分离汽油和氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Na+、Cl-、OH- | B. | Fe3+、H+、Cl-、CH3COO- | ||
| C. | Fe3+、SCN-、K+、Cl- | D. | H+、Fe2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
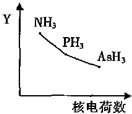 氮族元素氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的是( )
氮族元素氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的是( )| A. | 相对分子质量 | B. | 稳定性 | C. | 沸点 | D. | R-H键长 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
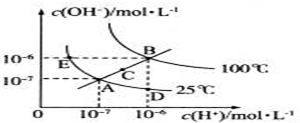
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸、食盐水 | B. | 氨水、碘酒 | C. | 石灰水、硝酸 | D. | 稀硫酸、食醋 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
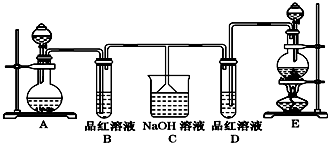
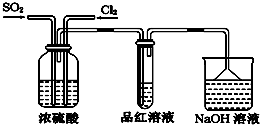
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com