
【题目】我国油气资源匮乏而煤储量相对丰富。将煤转化为水煤气(CO、H2),不可能产生的效果是
A. 得到相对清洁的能源 B. 提高了能源利用率
C. 增加了单位质量煤的热值 D. 便于管道输送
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是
A.2molH2O的摩尔质量和1molH2O的摩尔质量
B.200mL 1mol/L氯化钙溶液中c(Cl-)和100mL 2 mol/L氯化钾溶液中c(Cl-)
C.64gSO2中氧原子数和标准状况下22.4LCO中氧原子数
D.20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将pH=5的H2SO4的溶液稀释1000倍后,溶液中SO42-离子浓度与H+离子浓度的比值约为
A. 1:10 B. 1:1 C. 1:2 D. 1:20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.40 | 0.10 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.30 | a |
④ | 900 | 0.10 | 0.15 | b |
(1) 实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率等于____________。
(2) 实验②中,该反应的平衡常数K=____________。
(3) 实验③中,达到平衡时,X的转化率为____________。
(4) 实验④中,达到平衡时,b____________0.060 (填大于、小于、等于)
(5) 实验③中,达到平衡时,a等于 ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,当关闭K时,向A 中充入2molX、7molY,向B中充入4molX、14molY,起始时体积V(A)=V(B)=a L,在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:2X(g)+2Y(g)![]() Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a L,试回答:
Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a L,试回答:
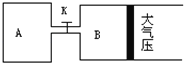
(1)B中X的转化率α(X)B为_________。
(2)A中W和B中Z的物质的量的比较:n(W)A __________________ n(Z)B(填<、>、或=)
(3)打开K,过一段时间重新达平衡(Ⅱ)时,B的体积为_________升(用含a的代数式表示,连通管中气体体积不计)
(4)要使B容器恢复原来反应前的体积,可采取的措施是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中的曲线表示的是其他条件一定时,反应:2NO+02![]() 2N02 △H<0中N0的平衡转化率与温度的关系。图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)﹤v(逆)的点是 ( )
2N02 △H<0中N0的平衡转化率与温度的关系。图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)﹤v(逆)的点是 ( )
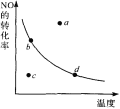
A.a点 B.b点 C. c点 D.d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相同的三种溶液:①氯化铵、②氨水、③硫酸氢铵,c(NH4+)大小顺序正确的是
A. ①>②>③ B. ③>②>① C. ②>③>① D. ③>①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素。氮及其化合物在在工农业生产、生活中有着重要作用。
(1)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) ![]() 2NH3(g),△H<0,其平衡常数K与温度t的关系如下表
2NH3(g),△H<0,其平衡常数K与温度t的关系如下表
T/K | 298 | 398 | 498 |
平衡常数K | 4.1 x 106 | K1 | K2 |
如果合成氨反应的方程式写为![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g),其平衡常数为K’,则K’与K之间关系的数学表达式为_________________;根据已知条件可判定K1____________K2(填“>”“<”或“=”)
NH3(g),其平衡常数为K’,则K’与K之间关系的数学表达式为_________________;根据已知条件可判定K1____________K2(填“>”“<”或“=”)
(2)下列能说明合成氨反应已达到平衡状态的是___________(填序号)。(反应是在固定体积的密闭容器中进行的)
A.容器内温度保持不变
B.v正(N2)=3v逆(H2)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
(3)合成氨工业中,按照勒夏特列原理,工业生产中应采用的条件为高压、低温,但事实上反应中并未采用较低的温度,原因是_____________________。
(4)硝酸工业在国民经济、国防工业和航天事业中占有重要地位。随着化学纤维、近代有机合成、火箭、导弹等工业迅速发展,需要使用大量的硝酸。
①工业生产中用铂系金属作为催化剂,用氨氧化法制取硝酸。第一步反应为氨在催化剂作用下与氧气发生反应生成NO,写出反应的化学方程:________________________。
②铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3 → Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平)。反应中的还原产物是_________________, 0.8mol Cu被硝酸完全溶解后,如果得到NO和NO2物质的量相同,那么标准状况下的气体体积为_________________L。(标况下NO和NO2视为气体)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com