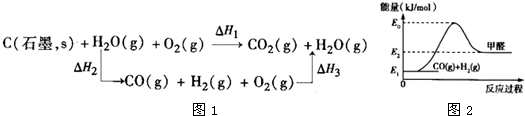将煤转化为水煤气的主要化学反应为C(石墨,s)+H
2O(g)═CO(g)+H
2(g).已知:C(石墨,s)、H
2(g)和CO(g)的燃烧热分别是393.5kJ/mol、285.8kJ/mol、283.0kJ/mol;H
2O(g)=H
2O(l)△H=-44.0kJ/mol.
请回答下列问题:
(1)根据以上数据,写出C(石墨,s)与水蒸气反应的热化学反应方程式:
C(石墨,s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol
C(石墨,s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol
.
(2)比较反应热数据可知,1mol CO(g)和1mol H
2(g)完全燃烧放出的热量之和比1mol C(石墨,s)完全燃烧放出的热量多.甲同学据此认为“煤转化为水煤气可以使燃烧放出更多的热量”;乙同学根据盖斯定律作出如图1所示循环图,并据此认为“煤转化为水煤气后再燃烧放出的热量与煤直接燃烧放出的热量相等”.
请评价甲、乙两同学的观点,正确的是
乙
乙
(填“甲”或“乙”),判断的理由是
甲同学忽略了煤转化为水煤气要吸收热量
甲同学忽略了煤转化为水煤气要吸收热量
.
(3)人们把拆开1mol化学键所吸收的能量看成该化学键的键能.已知:石墨、O
2分子中化学键的键能分别是460.7kJ/mol、497kJ/mol,则C=O键的键能为
1136.3
1136.3
kJ/mol.
(4)炼铁高炉中可将煤转化为CO再还原铁的氧化物,已知炼铁过程中有下列热化学方程式:
①Fe
2O
3(s)+3CO(g)=2Fe(s)+3CO
2(g)△H=-24.8kJ/mol
②Fe
2O
3(s)+CO(g)=2Fe
3O
4(s)+CO
2(g)△H=-47.2kJ/mol
③Fe
3O
4(s)+CO(g)=3FeO(s)+CO
2(g)△H=+640.4kJ/mol
由FeO固体得到Fe固体和CO
2气体时对应的△H约为
-218.0
-218.0
kJ/mol.
(5)水煤气也是重要的有机化工原料.CO和H
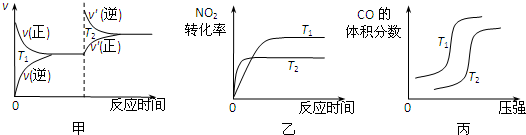
2在一定条件下可以合成甲醛,能满足“绿色化学”的要求,完全利用原料中的原子,实现零排放.该反应过程的能量变化如图2所示.该反应属于
吸热
吸热
(填“吸热”或“放热”)反应,该反应的△H=
反应物质的总能量-生成物的总能量
反应物质的总能量-生成物的总能量
.



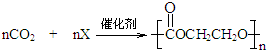 ,则X的结构简式为
,则X的结构简式为