
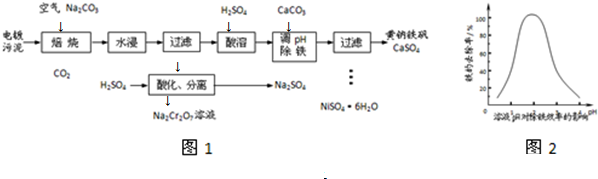
分析 将电镀污泥、碳酸钠和空气焙烧,发生反应2Cr2O3+4Na2CO3+3O2$\frac{\underline{\;高温\;}}{\;}$4Na2CrO4+4CO2↑,然后水浸Na2CrO4溶于水、NiO和Fe2O3难溶于水,然后过滤得到滤液,向滤液中加入稀硫酸,发生反应2CrO42-+2H+=Cr2O72-+H2O,然后利用物质的溶解度不同分离得到硫酸钠和Na2Cr2O7溶液;
向滤渣中加入稀硫酸,发生反应NiO+H2SO4=NiSO4+H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,向溶液中加入CaCO3来中和溶液中的酸,同时调节溶液的pH,根据图2知,pH为1.5-2.5时铁元素的去除率较大,根据流程图知,生成的沉淀有NaFe3(SO4)2(OH)6、CaSO4,所以去除铁元素时发生的离子反应方程式为3Fe3++3CaCO3+Na++5SO42-+3H2O=NaFe3(SO4)2(OH)6+3CaSO4+3CO2↑,然后过滤得到沉淀NaFe3(SO4)2(OH)6、CaSO4和溶液NiSO4,然后采用蒸发浓缩、冷却结晶方法得到NiSO4•6H2O晶体,据此分析解答.
解答 解:将电镀污泥、碳酸钠和空气焙烧,发生反应2Cr2O3+4Na2CO3+3O2$\frac{\underline{\;高温\;}}{\;}$4Na2CrO4+4CO2↑,然后水浸Na2CrO4溶于水、NiO和Fe2O3难溶于水,然后过滤得到滤液,向滤液中加入稀硫酸,发生反应2CrO42-+2H+=Cr2O72-+H2O,然后利用物质的溶解度不同分离得到硫酸钠和Na2Cr2O7溶液;
向滤渣中加入稀硫酸,发生反应NiO+H2SO4=NiSO4+H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,向溶液中加入CaCO3来中和溶液中的酸,同时调节溶液的pH,根据图2知,pH为1.5-2.5时铁元素的去除率较大,根据流程图知,生成的沉淀有NaFe3(SO4)2(OH)6、CaSO4,所以去除铁元素时发生的离子反应方程式为3Fe3++3CaCO3+Na++5SO42-+3H2O=NaFe3(SO4)2(OH)6+3CaSO4+3CO2↑,然后过滤得到沉淀NaFe3(SO4)2(OH)6、CaSO4和溶液NiSO4,然后采用蒸发浓缩、冷却结晶方法得到NiSO4•6H2O晶体,
(1)通过以上分析知,三氧化二铬和碳酸钠、氧气在高温下反应方程式为2Cr2O3+4Na2CO3+3O2$\frac{\underline{\;高温\;}}{\;}$4Na2CrO4+4CO2↑,
故答案为:2Cr2O3+4Na2CO3+3O2$\frac{\underline{\;高温\;}}{\;}$4Na2CrO4+4CO2↑;
(2)根据以上分析知,酸性条件下CrO42-和氢离子反应生成Cr2O72-和水,离子方程式为2CrO42-+2H+=Cr2O72-+H2O,故答案为:2CrO42-+2H+=Cr2O72-+H2O;
(3)①根据图2知,pH在0-3左右,pH越大铁元素的去除率越高,pH>3后,pH越大铁元素的去除率减小,铁的去除率在pH为1.5-2.5时较高,故选B;
②根据以上分析知,发生的离子反应方程式为3Fe3++3CaCO3+Na++5SO42-+3H2O=NaFe3(SO4)2(OH)6+3CaSO4+3CO2↑,
故答案为:3Fe3++3CaCO3+Na++5SO42-+3H2O=NaFe3(SO4)2(OH)6+3CaSO4+3CO2↑;
③胶体颗粒小,沉淀速率慢且不容易过滤,导致除铁效率低,故答案为:生成Fe(OH)3胶体的颗粒小、沉淀速率慢、不容易过滤等;
(4)从溶液中获取晶体的方法为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥,蒸发浓缩增大溶液浓度,洗涤除去杂质,故答案为:蒸发浓缩;洗涤.
点评 本题考查物质分离和提纯,为高考高频点,侧重考查学生对化工生产的了解,涉及物质性质、实验基本操作,明确物质反应原理是解本题关键,知道流程图中各个步骤发生的反应及操作方法,能从整体上把握分析,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
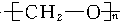 ,它是通过加聚反应制得的,则合成象牙的单体是( )
,它是通过加聚反应制得的,则合成象牙的单体是( )| A. | (CH3)2O | B. | CH3CHO | C. | HCHO | D. | C2H2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 电池的总反应式:Cd+2NiOOH+2H2O$?_{充电}^{放电}$2Ni(OH)2+Cd(OH)2 | |
| B. | 电池充电时,镉元素被还原 | |
| C. | 电池放电时,电池负极周围溶液的pH不断增大 | |
| D. | 电池充电时,电池的负极和电源的正极连接 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷 | B. | 乙烷 | C. | 丙烷 | D. | 丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 据2004年1月17日网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,是一种高能量分子.
据2004年1月17日网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,是一种高能量分子.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com