
【题目】某原电池装置如下图所示,电池总反应为2Ag+Cl2==="2AgCl" 。下列说法正确的是
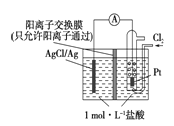
A. 正极反应为AgCl+e-===Ag+Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
科目:高中化学 来源: 题型:
【题目】下列有关表述与图像对应关系不正确的是
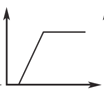



图1 图2 图3 图4
A.图1:往Na2CO3和NaOH混合液中逐滴加入盐酸,产生气体体积与盐酸的物质的量的关系
B.图2:往澄清石灰水中通入过量CO2气体,产生沉淀质量与CO2的物质的量的关系
C.图3:往AlCl3和MgCl2混合液中逐滴加入NaOH溶液,产生沉淀质量与NaOH溶液的物质的量的关系
D.图4:若MOH和ROH表示两种一元碱,则ROH的碱性强于MOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是( )
A.反应前2 min的平均速率v(Z)=2.0×10-3 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v逆>v正
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含c(NH4Cl)=3c(AlCl3)的溶液中滴加稀NaOH溶液。下列离子方程式不符合实际情况的是( )
A. Al3++3NH![]() +6OH-===Al(OH)3↓+3NH3·H2O
+6OH-===Al(OH)3↓+3NH3·H2O
B. Al3++5NH![]() +9OH-===5NH3·H2O+AlO
+9OH-===5NH3·H2O+AlO![]() +7H2O
+7H2O
C. 2Al3++NH![]() +7OH-===2Al(OH)3↓+NH3·H2O
+7OH-===2Al(OH)3↓+NH3·H2O
D. Al3++3NH![]() +7OH-===AlO
+7OH-===AlO![]() +3NH3·H2O+2H2O
+3NH3·H2O+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由短周期元素形成的化合物A2B3,A3+比B2+少一个电子层,且A3+具有与Ne原子相同的核外电子层结构,下列说法正确的是( )
A. A2B3是三氧化二铝
B. A3+与B2﹣最外层上的电子数相同
C. A是第2周期第ⅢA族的元素
D. B是第3周期第ⅥA族的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为说明氯比硫的非金属性强,下列事实可作依据的是
A. HCl的溶解性强于H2S
B. 氯的最高价为+7价
C. H2S中的S2-能被Cl2氧化
D. HClO的氧化性强于H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“嫦娥一号”的四大科学目标之一是探测下列14种元素在月球上的含量和分布:K、Th(钍)、U(铀)、O、Si、Mg、Al、Ca、Fe、Ti(钛)、Na、Mn、Cr(铬)、Gd(钆),其中属于主族元素的有( )
A. 4种 B. 5种 C. 6种 D. 7种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫常温下为无色有刺激性气味的有毒气体,易液化,易溶于水。某同学设计如下实验方案,对二氧化硫的化学性质进行探究,装置如下图所示。请回答下列问题:

(1)反应结束时烧瓶中Cu由剩余,某同学认为H2SO4也有剩余,他设计了下列实验方案来测定剩余H2SO4的量。经冷却,定量稀释后进行下列实验,能达到的目的是 (填序号)
a.用酸碱中和滴定法测定
b.与足量Zn反应,测量生成H2的体积
c.用pH计测溶液PH值
d.与足量BaCl2溶液反应,称量生成沉淀的质量
(2)装置B的作用是 ,设计装置C的目的是验证SO2的 性,装置C中发生反应的离子方程式 ,装置D中NaOH全部转化为NaHSO3的标志是____________
(3)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能情况:
I.HSO3-与ClO-刚好反应完; Ⅱ.NaClO不足; Ⅲ.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成下表:(已知酸性:H2SO3>H2CO3>HClO)
实验序号 | 实验操作 | 现象 | 反应的可能情况 |
① | 加入几小块CaCO3固体 | 有气泡产生 | |
② | 滴加少量淀粉KI溶液,振荡 | Ⅲ | |
③ | 滴加少量溴水,振荡 | Ⅱ | |
④ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液为紫色 |
(4)设计简单实验证明:室温下HSO3-的电离平衡常数Ka与水解平衡常数Kb的相对大小 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com