
【题目】在无色透明的碱性溶液中能大量共存的离子组是
A.Fe3+、Na+、Cl-、HCO3-B.K+、Na+、NO3-、CO32-
C.Mg 2+、H+、NO3-、SO42-D.K+、MnO4-、Na+、Cl-
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】以化合物A为原料合成化合物M的线路如下图所示。

(1)写出化合物B中含氧官能团的名称为________________。
(2)①的反应类型为________________。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式_____________。
①能与FeCl3发生显色反应; ②分子中有3种不同化学环境的氢;
(4)E与Y反应生成M同时还生成甲醇,写出Y(C5H8O4)的结构简式__________________。
(5)以苯酚、乙醇、![]() 为有机原料合成
为有机原料合成 ,写出制备的合成路线流程图 (无机试剂任用,合成路线流程图示例见本题题干)______________。
,写出制备的合成路线流程图 (无机试剂任用,合成路线流程图示例见本题题干)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是几种常见的化学电源示意图,有关说法正确的是

A. 上述电池分别属于一次电池、二次电池和燃料电池
B. 干电池工作时,H+向锌筒移动
C. 铅蓄电池工作过程中,每通过2mol电子,负极质量减轻207g
D. 酸性氢氧燃料电池的正极反应式为O2 + 4H+ + 4e-= 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低碳经济是以低能耗、低污染、低排放为基础的经济模式,低碳经济的概念在中国正迅速从高端概念演变成全社会的行为,在新能源汽车、工业节能等多个领域都大有作为.请运用化学反应原理的相关知识研究碳及其化合物的性质
(1)工业上可利用CO或CO2来制备燃料甲醇.
已知:800℃时,化学反应①、反应②对应的平衡常数分别为2.5、1.0
反应①:2H2(g)+CO(g)CH3OH(g)△H=-90.8kJmol-1
反应②:H2(g)+CO2(g)H2O(g)+CO(g)△H=+41.2kJmol-1
写出用CO2与H2反应制备甲醇的热化学方程式___________.
800℃时该反应的化学平衡常数K的数值为___________.
(2)现将不同量的CO2(g)和H2(g)分别通入到容积为2L的恒容密闭容器中发生反应: CO(g)+H2O(g)CO2(g)+H2(g)ΔH=+41.2KJ/mol,得到如下二组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
CO2(g) | H2(g) | H2O(g) | CO2(g) | |||
1 | 900 | 4 | 2 | 1.6 | 2.4 | 2 |
2 | 900 | a | b | c | d | t |
实验2中,若平衡时,CO2(g)的转化率小于H2(g).则a、b必须满足的关系是__________。
若在900℃时,另做一组实验,在此容器中加入10molCO2(g),5molH2,2molCO,5molH2O(g),则此时v正____v 逆(填“<”>“或“=”)。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:CH3OH(g)+CO(g) ![]() HCOOCH3(g) ΔH=-29.1 kJ·mol-1,科研人员对该反应进行了研究,部分研究结果:
HCOOCH3(g) ΔH=-29.1 kJ·mol-1,科研人员对该反应进行了研究,部分研究结果:

①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是________。 (填“3.5×106 Pa”、 “4.0×106 Pa”或““5.0×106 Pa”)。
②实际工业生产中采用的温度是80℃,其理由是_________________。
(4)常温下,向20.0mLcmol/L的氨水中滴加20mL.0.2mol/LHNO3溶液后,恰好使溶液显中性(设混合溶液总体积为两溶液体积之和)。计算常温下NH3·H2O![]() NH4++OH-的电离平衡常数K(NH3·H2O)=_________(用含c的式子表示)。
NH4++OH-的电离平衡常数K(NH3·H2O)=_________(用含c的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于图示的说法正确的是( )




A. 图①可表示恒温恒压条件下充入H2(g)和I2(g),t1时达到平衡,相同条件下t2时又充入一定量HI(g),t3时再次达到平衡
B. 图②表示用0.1000mol/L盐酸滴定20.00mL未知浓度的一元碱MOH溶液的滴定曲线,由此可判断出使用的酸碱指示剂为酚酞
C. 图③表示反应物A的平衡转化率和压强、温度的关系,可以判断可逆反应mA(g)+nB(g)![]() pC(g)△H>0,且m+n>p
pC(g)△H>0,且m+n>p
D. 由图④判断除去CuSO4溶液中杂质Fe3+,可向溶液中加入适量固体NaOH,调pH为4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关糖类的说法,错误的是( )
A.糖类由碳、氢、氧三种元素组成
B.糖类是人类食物的重要成分之一
C.在人类食物所提供的总能量中大约有75%来自糖类
D.淀粉在人体内经酶的催化作用,与水发生一系列反应,最终变为蔗糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.
(1)滴定原理为:(用离子方程式表示).
(2)滴定时,KMnO4溶液应装在(填“酸式”或“碱式”)滴定管中,达到滴定终点时的现象为 .
(3)如图表示50mL滴定管中液面的位置,此时滴定管中液面的读数为mL.
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 26.32 | 25.35 | 25.30 |
从上表可以看出,第一次实验中记录消耗KMnO4溶液的体积明显多于后两次,其原因可能是
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积.
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡.
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,后两次均用标准液润洗.
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗.
E.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定.
(5)根据所给数据,写出计算H2C2O4的物质的量浓度的表达式(不必化简):C=mol/L.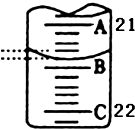
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有“锂”走遍天下。氧化锂(Li2O)是锂电池工业的重要原料,以粗碳酸锂为原料制备氧化锂的一种工艺流程如下:
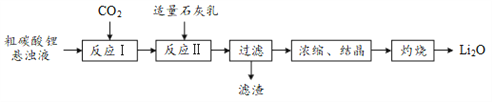
注:常温下,碳酸锂微溶于水,氢氧化锂可溶于水。
(1)反应Ⅰ中通入CO2需加压的原因是______。
(2)反应Ⅱ生成LiOH的化学方程式为______。
(3)浓缩、结晶所得LiOH·H2O通过灼烧得到Li2O。LiOH·H2O中常含有少量的Li2CO3,但该物质对所制Li2O的纯度无影响,其原因是______。
(4)锂离子电池大量应用在手机、笔记本电脑和家用小电器上。标记为Li-ion的锂离子电池的电池反应可表示为:Li + 2Li0.35NiO2![]() 2Li0.85NiO2。
2Li0.85NiO2。
①放电时,负极的电极反应式为______。
②充电时,能量转化形式主要是______。
③锂离子电池使用非水溶液做离子导体的原因是______(用离子方程式表示)。
④安全使用锂离子电池的措施有______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1 mol·L—1HCl溶液滴定10.0 mL浓度为0.1 mol·L—1 Na2CO3溶液,所得滴定曲线如图所示。下列说法正确的是

A. 当V=0时:c(H+)+c(HCO3-)+c(H2CO3)=c(OH-)
B. 当V=5时:c(CO32—)+c(HCO3-)+c(H2CO3)=c(Cl-)
C. 当V=10时:c(Na+)>c(HCO3-)>c(CO32—)>c(H2CO3)
D. 当V=a时:c(Na+)>c(Cl-)>c(H+)=c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com