
| A. | 金属钠加入水中:Na+H2O=Na++OH-+H2↑ | |
| B. | 碳酸氢钙溶液跟氢氧化钠溶液混合:HCO3-+OH-=CO32-+H2O | |
| C. | 氢氧化钡溶液滴入硫酸氢钠溶液至中性:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| D. | 亚硫酸钠和足量的稀硝酸混合:SO32-+2H+=SO2↑+H2O |
分析 A.原子个数不守恒;
B.碳酸氢钙溶液跟足量氢氧化钠溶液混合生成碳酸钙、碳酸钠和水;
C.二者反应生成硫酸钡和水;
D.硝酸能够氧化亚硫酸根离子生成硫酸根离子.
解答 解:A.金属钠加入水中,离子方程式:2Na+2H2O=2Na++2OH-+H2↑,故A错误;
B.碳酸氢钙溶液跟足量氢氧化钠溶液混合生成碳酸钙、碳酸钠和水,离子方程式:Ca2++2HCO3-+2OH-=CO32-+H2O+CaCO3↓,故B错误;
C.氢氧化钡溶液滴入硫酸氢钠溶液至中性,离子方程式:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故C正确;
D.酸性条件下,亚硫酸钠被硝酸氧化生成硫酸钠,离子反应方程式为:3SO32-+2H++2NO3-=3SO42-+2NO↑+H2O,故D错误;
故选:C.
点评 本题考查了离子反应方程式正误判断,明确物质的性质及发生反应的实质是解题关键,亚硫酸盐能被硝酸根离子氧化,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下①溶液显碱性,其主要原因为:CO32-+H2O=HCO3-+OH- | |
| B. | 可用澄清石灰水来鉴别①和②两种无色溶液 | |
| C. | 泡沫灭火器中用硫酸铝溶液和②混合快速产生CO2的反应原理为:Al3++3HCO3-=Al(OH)3↓+3CO2↑ | |
| D. | 无论①和②以何种比例、何种浓度混合,都一定有:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
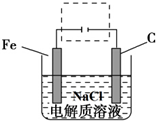 、Fe+2H2O$\frac{\underline{\;通电\;}}{\;}$Fe(OH)2(胶体)+H2↑
、Fe+2H2O$\frac{\underline{\;通电\;}}{\;}$Fe(OH)2(胶体)+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤⑥ | B. | ②③⑤⑥ | C. | ②③④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 28g氮气所含有的原子数目为NA | |
| B. | 常温常压下,32gO2含有的O原子数为NA | |
| C. | 1mol甲烷的质量与NA个甲烷分子的质量之和相等 | |
| D. | 标准状况下,22.4L 甲烷和乙炔的混合气体所含的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
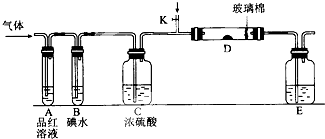 某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究S02和Cl2的性质.
某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究S02和Cl2的性质.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com