
把aL硫酸铵和硝酸铵的混合液分成两等份,一份加入bmol 烧碱并加热,刚好把NH3 全部赶出。另一份需消耗cmolBaCl2,沉淀反应刚好完全,原溶液中硝酸根离子的物质的量浓度为
A.![]() mol.l-1 B.
mol.l-1 B.![]() mol.l-1
mol.l-1
C.![]() mol.l-1 D.
mol.l-1 D.![]() mol.l-1
mol.l-1
本题的正确选项为D
对于混合溶液,首先分析溶液中有哪些离子,再分别求出各种离子的物质的量,利用电荷守恒法求解。离子反应有:NH4++OH-==NH3↑+H2O, Ba2++SO42-=BaSO4↓
由题意可知,aL混合液分成两等份:
其中一份有:NH4+―OH-, 另一份有:Ba2+―SO42-
bmol bmol cmol cmol
则aL混合液中,有2bmolNH4+,有2cmolSO42-,在溶液中,根据电荷守恒有:
2bmol×1=2cmol×2+c(NO3-)×aL×1,得c(NO3-)=![]() mol.l-1
mol.l-1
错误分析:解题过程中容易忽略离子反应是在混合溶液分成两等份以后进行的,用关系式求出NH4+、SO42-的物质的量误认为就是原溶液中NH4+和SO42-的物质的量,造成错选A。
解题指导:对于物质的量浓度的计算问题应准确掌握概念、公式,在应用时,还要注意溶质的质量守恒、物质的量守恒及溶液的电荷守恒、质量守恒等。
一、关于物质的量浓度的计算主要包括:
1. 溶质的质量、溶液的体积和物质的量浓度之间的计算。可运用公式:n=m/M,c=n/V或运用倍数关系算出1L溶液中所含溶质的物质的量。
2. 已知气体溶质的体积(标准状况下)、水的体积和溶液的密度,计算溶液的物质的量浓度。应先运用n=V(气体)/22.4L.mol-1,求出溶质的物质的量,运用V(溶液)=m/![]() ρ求出溶液的体积。
ρ求出溶液的体积。
3. 计算溶液中的离子浓度,需根据溶质的电离方程式,算出离子的物质的量。
二、溶液中的溶质的质量分数与物质的量浓度之间的换算
C=1000ρw/M按此公式换算即可
三、溶液稀释或混合的计算
根据稀释前后,溶液中溶质的物质的量不变的公式或溶质的质量不变的公式计算有关问题。
四、HCl、NH3 等气体经喷泉实验所得溶液浓度的无数据巧算方法: 令气体体积(标准状况)为1L(不论溶液是否充满烧瓶)喷泉后溶液体积亦为1L,故c=1/22.4mol.L-1为恒值;但w不为恒值,可根据气体摩尔质量、溶液密度来进行计算。


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源:2012-2013学年陕西省高三第一次月考化学试卷(解析版) 题型:选择题
把aL硫酸铵和硝酸铵的混合液分成两等份,一份加入bmol 烧碱并加热,刚好把NH3 全部赶出。另一份需消耗cmolBaCl2,沉淀反应刚好完全,原溶液中硝酸根离子的物质的量浓度为
A.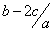 mol.l-1
B.
mol.l-1
B.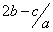 mol.l-1 C.
mol.l-1 C.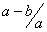 mol.l-1 D.
mol.l-1 D.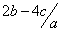 mol.l-
mol.l-
查看答案和解析>>
科目:高中化学 来源:2012届浙江省高二12月月考化学试卷 题型:选择题
把aL硫酸铵和硝酸铵的混合液分成两等份,一份加入b mol 烧碱并加热,刚好把NH3 全部赶出。另一份需消耗c molBaCl2,沉淀反应刚好完全,原溶液中硝酸根离子的物质的量浓度为
A. mol.l-1 B.
mol.l-1 B. mol.l-1
mol.l-1
C. mol.l-1 D.
mol.l-1 D. mol.l-1
mol.l-1
查看答案和解析>>
科目:高中化学 来源: 题型:
把aL硫酸铵和硝酸铵的混合液分成两等份,一份加入b mol 烧碱并加热,刚好把NH3 全部赶出。另一份需消耗c molBaCl2,沉淀反应刚好完全,原溶液中硝酸根离子的物质的量浓度为
A.![]() mol.l-1 B.
mol.l-1 B.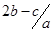 mol.l-1
mol.l-1
C.![]() mol.l-1 D.
mol.l-1 D.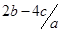 mol.l-1
mol.l-1
查看答案和解析>>
科目:高中化学 来源:2010—2011学年浙江省海盐元济高级中学高二12月月考化学试卷 题型:单选题
把aL硫酸铵和硝酸铵的混合液分成两等份,一份加入b mol 烧碱并加热,刚好把NH3全部赶出。另一份需消 耗c molBaCl2,沉淀反应刚好完全,
耗c molBaCl2,沉淀反应刚好完全, 原溶液中硝酸根离子的物质的量浓度为
原溶液中硝酸根离子的物质的量浓度为
A. mol.l-1 mol.l-1 | B. mol.l-1 mol.l-1 |
C. mol.l-1 mol.l-1 | D. mol.l-1 mol.l-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com