
 H++HS-,HS-
H++HS-,HS- H++S2-;
H++S2-;分析 先判断电解质的类型及电离出的阴阳离子,根据电解质的类型判断写可逆号还是等号;如果是多元弱电解质,要分步电离.
解答 解:(1)NaHSO4是强酸强碱酸式盐,属强电解质,完全电离,电离出Na+、H+、SO42-离子,故答案为:NaHSO4=Na++H++SO42-;
(2)H2S是二元弱酸,属弱电解质,分两步电离,第一步电离出氢离子和硫氢根离子,第二步电离:硫氢根离子电离出硫离子和氢离子,故答案为:H2S H++HS-,HS-
H++HS-,HS- H++S2-;
H++S2-;
(3)碳酸氢根离子水解的离子方程式:HCO3-+H2O?CO32-+OH-,故答案为:HCO3-+H2O?CO32-+OH-;
(4)氯化铁是强酸弱碱盐,溶液中铁离子水解,溶液显酸性,离子方程式为:Fe3++3H2O?Fe(OH)3+3H+,
故答案为:Fe3++3H2O?Fe(OH)3+3H+.
点评 本题考查了电离方程式的书写,书写方法为:
1、先判断物质类型;
2、确定用可逆号还是等号;
3、确定电离出的离子,
4、要注意原子守恒、电荷守恒.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:解答题
 ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③苯、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③苯、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.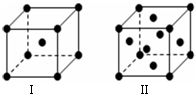
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78g过氧化钠晶体中,含2NA个阴离子 | |
| B. | 常温常压下,22.4L氦气含有NA个氦原子 | |
| C. | 在H2O2参与的反应中,1 mol H2O2得到或失去的电子数一定是2NA | |
| D. | 常温下16g O2与O3的混合气体中含氧原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{A}{a}$(N-a) mol | B. | $\frac{a}{A+n}$(n+A)mol | C. | $\frac{A}{a+n}$(N+n) mol | D. | $\frac{a}{A+n}$(A-N+n) mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gD2O中含有的质子数目为10NA | |
| B. | 12.0 g熔融的NaHSO4中含有0.1NA个Na+、0.1NA个H+和0.1NA个SO42- | |
| C. | 氢氧燃料电池工作时,若负极反应0.5g H2时,则正极反应的O2的体积(折算为标况)是2.8L | |
| D. | 22.4LNH3分子中含有的共价键数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能介于B、N之间的第二周期元素有1种 | |
| B. | 基态Fe原子的外围电子排布图为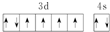 | |
| C. | 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 | |
| D. | 根据原子核外电子排布的特点,Cu在元素周期表中位于s区 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
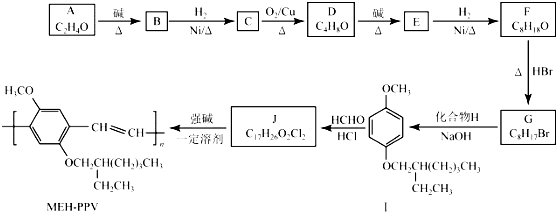
 +H2O (R、R′表示烃基或氢)
+H2O (R、R′表示烃基或氢) (R、R′表示烃基烷氧基)
(R、R′表示烃基烷氧基)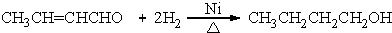 .
.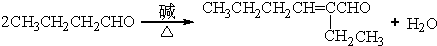 .
.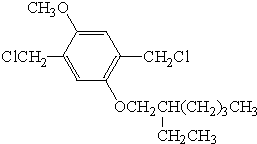 .
.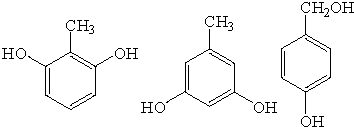 .
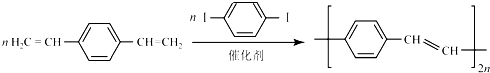
.
 、
、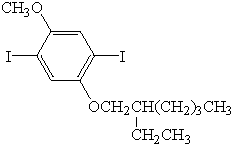 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com