【答案】
分析:A、B两元素以4:1组成的化合物甲为气体,则甲为CH
4,A为H元素,B为C元素,由A、C组成的两种化合物乙和丙都为液态,乙中A、C原子数之比为1:1,丙中为2:1,则C为O元素,形成的化合物分别为H
2O
2、H
2O,由D、C组成的两种化合物丁和戊都为固态,丁中D、C原子数之比为1:1,戊中为2:1,则D为Na元素,形成的化合物分别为Na
2O
2、Na
2O,C、E组成的化合物既能够溶于硫酸又能够溶于D的水溶液,说明E为Al元素,形成的化合物Al
2O
3具有两性,根据元素所在周期表中的位置结合元素周期律的递变规律来解答元素、原子以及对应化合物的结构和性质.
解答:解:A、B两元素以4:1组成的化合物甲为气体,则甲为CH
4,A为H元素,B为C元素,由A、C组成的两种化合物乙和丙都为液态,乙中A、C原子数之比为1:1,丙中为2:1,则C为O元素,形成的化合物分别为H
2O
2、H
2O,由D、C组成的两种化合物丁和戊都为固态,丁中D、C原子数之比为1:1,戊中为2:1,则D为Na元素,形成的化合物分别为Na
2O
2、Na
2O,C、E组成的化合物既能够溶于硫酸又能够溶于D的水溶液,说明E为Al元素,形成的化合物Al
2O
3具有两性.
(1)由以上分析可知,甲为CH
4,丙为H
2O,丁为Na
2O
2,O元素的化合价为-1价,戊为Na
2O,含有Na元素,焰色反应呈黄色,乙为H
2O
2,电子式为
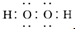
,故答案为:甲烷;H
2O;-1;黄;
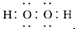
;
(2)元素B的最高价氧化物为CO
2 ,丁为Na
2O
2,二者反应的化学方程式为2Na
2O
2 +2CO
2 =2Na
2CO
3 +O
2,
故答案为:2Na
2O
2 +2CO
2 =2Na
2CO
3 +O
2;
(3)含Al
3+离子的硫酸盐溶液中逐滴滴加NaOH的稀溶液,先生成Al(OH)
3沉淀,Al(OH)
3具有两性,能继续与NaOH反应生成AlO
2-,反应的离子方程式为Al
3++3OH
-=Al(OH)
3↓;Al(OH)
3+OH
-=AlO
2-+2H
2O,
故答案为:Al
3++3OH
-=Al(OH)
3↓;Al(OH)
3+OH
-=AlO
2-+2H
2O;
(4)甲烷与氧气通入到含过量的Na
2O
2 密闭容器中,电火花引燃,维持温度在120℃,充分反应后容器内压强几乎为零,则参加反应的气体全部生成固体,根据质量守恒可知生成物应为Na
2CO
3和NaOH,根据甲烷的组成可知Na
2CO
3与NaOH物质的量之比为1:4,反应的方程式为2CH
4+O
2+6Na
2O
2=2Na
2CO
3+8NaOH,由方程式可知甲烷和氧气的物质的量之比为2:1,
故答案为:2:1;2CH
4+O
2+6Na
2O
2=2Na
2CO
3+8NaOH.
点评:本题考查元素的位置结构性质的相互关系及应用,题目难度中等,注意根据常见化合物的形式推断元素的种类,注重基础知识的积累.

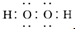 ,故答案为:甲烷;H2O;-1;黄;
,故答案为:甲烷;H2O;-1;黄;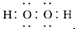 ;
;

 一线名师权威作业本系列答案
一线名师权威作业本系列答案 A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系.请回答:
A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系.请回答:


