
(1)在298K时,1mol C2H6 在氧气中完全燃烧生成CO2和液态水,放出热量1558.3kJ。写出该反应的热化学方程式 。
(2)利用该反应设计一个燃料电池:用KOH溶液作电解质溶液,多孔石墨作电极,在电极上分别通入乙烷和氧气。通入乙烷气体的电极应为 极(填“正”或“负”),该电极上发生的电极反应式为 。
(3)在右图所示实验装置中,石墨棒上的电极反应式为 。如果起始时盛有1L pH=5的CuSO4溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是 。若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填物质名称),其质量约为 。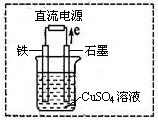
(4)将普通碳钢钉放入“84消毒液”(NaClO溶液)中浸泡一段时间。预期的实验现象是 。
(5)为了进一步探究碳钢钉在该消毒液(NaClO)中的腐蚀原理,某同学设计了如图所示实验装置,写出碳(C)极上发生的电极反应式 。
(1)2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) △H=?3116.6 kJ·mol-1(2分)
(2)负 C2H6+18OH-?14e-=2CO32-+12H2O
(3)4OH-?4e-=2H2O+O2↑(2H2O?4e-=O2↑+4H+)
石墨电极表面有气泡产生,铁电极上附着一层红色物质,溶液颜色变浅氧化铜(或碳酸铜) 4g(或6.2g)
(4)钢钉表面有红褐色物质生成
(5)ClO-+H2O+2e-=Cl-+2OH-
解析 试题分析:(1)依据热化学方程式的书写原则结合定量关系写出反应为生成物、各物质的聚集状态、对应反应的焓变得到热化学方程式为:2 C2H6(g)+7 O2(g)→4 CO2(g)+6 H2O(l)△H=-3116.6 kJ/mol;
试题分析:(1)依据热化学方程式的书写原则结合定量关系写出反应为生成物、各物质的聚集状态、对应反应的焓变得到热化学方程式为:2 C2H6(g)+7 O2(g)→4 CO2(g)+6 H2O(l)△H=-3116.6 kJ/mol;
故答案为:2 C2H6(g)+7 O2(g)→4 CO2(g)+6 H2O(l)△H="-3116.6" kJ/mol;
(2)利用反应①2 C2H6(g)+7 O2(g)→4 CO2(g)+6 H2O(l)△H="-3116.6" kJ/mol;设计原电池,根据化合价变化分析判断,乙烷失电子发生氧化反应,所以通入乙烷气体的电极应为负极,正极电极反应为:②O2+2H2O+4e-=4OH-; ①-②×7 得到负极电极反应为:C2H6-14e-+18OH-═2CO32-+12H2O;(3)如图所示实验装置中,石墨棒上是电子流出一端,电解池中电子流出的是阳极,所以阳极电极反应为氢氧根离子放电,电极反应为:4OH--4 e-═O2↑+2H2O;惰性电极电解硫酸铜溶液生成铜、氧气、硫酸,恢复原溶液浓度需要加入析出的物质,即加入氧化铜可以恢复,故答案为:4OH--4 e-═O2↑+2H2O;CuO;将碳钢铁钉浸在次氯酸钠中,会发生电化学腐蚀。其中铁为负极,碳为正极。铁失电子,因为次氯酸根离子的强氧化性,次氯酸根离子得电子生成Cl—。故(4)钢钉表面有红褐色物质生;(5)ClO-+H2O+2e-═Cl-+2OH-
考点:考查热化学方程式、电化学原理等相关知识。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ·mol-1。请回答下列问题: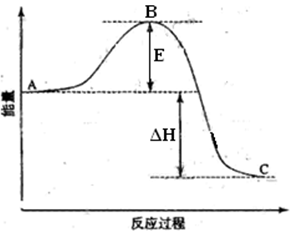
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热 (填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”还是“降低”),△H (填“变大”、“变小”或“不变”),理由是 。
(2)图中△H= KJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)已知热化学方程式:
4Al(s) + 3O2(g) = 2Al2O3 (s) ΔH1=-3288.6 kJ·mol-1,
4Fe(s) + 3O2 (g) =2Fe2O3 (s) ΔH2=-1631.8 kJ·mol-1,
则铝粉与氧化铁发生铝热反应的热化学方程式为 。
(2)已知标准状况下44.8L氢气燃烧生成液态水时放出571.6KJ的热量,氢气的燃烧热为 ;又已知1mol液态水变成气态时需要吸收44KJ的热量,则标准状况下22.4L氢气燃烧生成气态水的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用。
(1)一定温度下,在1L容积恒定的密闭容器中充入2 mol N2和8molH2并发生反应。10min达平衡,测得氨气的浓度为0.4 mol·L-1,此时氮气的转化率为________。若想提高氨气的产率,根据化学平衡移动原理,提出合理的建议______________(写出一条即可)。
(2)如图是1mol NO2(g)和1mol CO(g)反应生成lmol CO2(g)和1 mol NO(g)过程中能量变化示意图,请写出该反应的热化学方程式_____________________。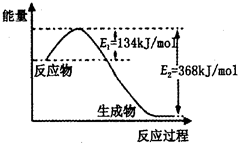
(3)在容积恒定的密闭容器中,进行如下反应:N2(g)+3H2(g) 2NH3(g) △H<0,其平衡常数K与温度T的关系如下表:
2NH3(g) △H<0,其平衡常数K与温度T的关系如下表: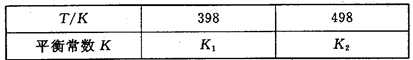
①该反应的平衡常数表达式:K=_____________;
②试判断K1__________K2(填写“>”“=”或“<”=;
③NH3(g)燃烧的方程式为:4NH3(g)+7O2(g)=4NO2(g)+6H2O(l),已知:
H2(g)+O2(g) 2H2O(l) △H=-483.6 kJ/mol
2H2O(l) △H=-483.6 kJ/mol
N2(g)+2O2(g) 2NO2(g) △H=+67.8 kJ/mol
2NO2(g) △H=+67.8 kJ/mol
N2(g)+3H2(g) 2NH3(g) △H=-92.0 kJ/mol
2NH3(g) △H=-92.0 kJ/mol
请计算NH3(g)的燃烧热________kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
SO2和NOx在化学工业上有重要用途,也是大气污染的主要来源,开发和利用并重,预防和治理并举是当前工业上和环境保护领域研究的主要课题之一。
(1)在接触法制硫酸的过程中,发生2SO2(g)+O2(g)  2SO3(g) △H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题:
2SO3(g) △H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题: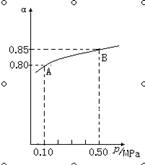
①平衡状态由A到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”);
②将2.0molSO2和1.0molO2置于10L的密闭容器中,若40s后反应达到平衡,此时体系总压强为0.10MPa,这一段时间内SO2的平均反应速率为 。
该反应的平衡常数为 。
(2)用CH4催化还原NOx可消除氮的氧化物的污染,例如:CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol—1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol—1
取标准状况下4.48LCH4并使之完全反应:
①若将NO2还原至N2,整个过程中转移电子的物质的量为 ;
②若还原NO2和NO的混合物,放出的总热量Q的取值范围是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。已知: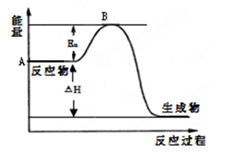
2CO(g)+O2(g)=2CO2(g) ΔH =-566 kJ·moL-1
2H2(g)+O2(g)=2H2O(g) ΔH =-483.6 kJ·moL-1
H2O(g)=H2O(l) ΔH =-44.0 kJ·moL-1
(1)氢气的标准燃烧热△H = kJ·moL-1。
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式: 。
(3)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)已知下列两个热化学方程式:
C3H8(g)+5O2(g) =3CO2(g)+4H2O(l) ΔH=-2220.0 kJ·mol-1
H2O(l)=H2O(g) ΔH="+44.0" kJ·mol-1
则0.5 mol丙烷燃烧生成CO2和气态水时释放的热量为___________ 。
(2)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如下图所示),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________ kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________ kJ能量。
(3)阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:
2H2+O2=2H2O,电解质溶液为稀H2SO4溶液,电池放电时是将_________能转化为___________能。其电极反应式分别为:
负极_________________________,正极_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
摩托罗拉公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可以连续使用一个月。已知该电池的总反应式为:
2CH3OH+3O2+4KOH 2K2CO3+6H2O
2K2CO3+6H2O
请填空:
(1)放电时:负极的电极反应式为_________________________________________________________。
(2)通入甲醇一端的电极是________极,电池在放电过程中溶液的pH将_______ (填“上升”、“下降”或“不变”)。
(3)若在常温、常压下,1 g CH3OH燃烧生成CO2和液态水时放出22.68 kJ的热量,表示该反应的热化学方程式为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二甲醚是—种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
(1)煤的气化的主要化学反应方程式为_______________________________________。
(2)煤的气化过程中产生的有害气体用溶液吸收,生成两种酸式盐,该反应的
化学方程式为__________________________________________________________。
(3)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g);△H=-90.8kJ·mol-1
CH3OH(g);△H=-90.8kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g);△H=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g);△H=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g);△H=-41.3kJ·mol-1
CO2(g)+H2(g);△H=-41.3kJ·mol-1
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H= ;
CH3OCH3(g)+CO2(g)的△H= ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是
________________(填字母代号)。
a.高温b.加入催化剂c.减少CO2的浓度d.增加CO的浓度e.分离出二甲醚
(4)已知反应②2CH3OH(g)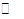 CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。
此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L) | 0.44 | 0.6 | 0.6 |
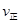 _______
_______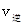 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com