



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、氯化铝溶液中加入过量氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、氧化亚铁溶于稀盐酸:FeO+2H+=Fe2++H2O |
| C、二氧化硅与烧碱溶液反应:SiO2+2OH-=SiO32-+H2O |
| D、除去氧化膜的铝片插入硝酸汞溶液中:2Al+3Hg2+=2Al3++3Hg |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 |
| 溶度积 | 2.8×10-9 | 6.8×10-6 | 5.5×10-6 | 1.8×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
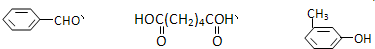
 互为同分异构体的是
互为同分异构体的是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知:A、B、C、D、E、G、L七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;L原子核外最外层电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、G的原子均有三个能层,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;C与G能形成原子数目比为1:3、熔点为190℃的化合物Q.
已知:A、B、C、D、E、G、L七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;L原子核外最外层电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、G的原子均有三个能层,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;C与G能形成原子数目比为1:3、熔点为190℃的化合物Q.查看答案和解析>>
科目:高中化学 来源: 题型:

| A、K与N连接时,X为硫酸,一段时间后溶液的pH减小 |
| B、K与N连接时,X为氯化钠,石墨电极反应:2H++2e-=H2↑ |
| C、K与M连接时,X为氯化钠,石墨电极反应:4OH--4e-=2H2O+O2↑ |
| D、K与M连接时,X为硫酸,一段时间后溶液的pH减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com