
| A. | 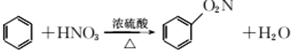 | |
| B. | CH2═CH2+Br2-→CH3CHBr2 | |
| C. | CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3CH2OCH2CH3+H2O | |
| D. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl |
分析 A.硝基苯中C与N成键;
B.发生加成反应,乙烯中两个C上各引入一个Br原子;
C.发生酯化反应生成乙酸乙酯;
D.发生取代反应生成一氯甲烷与HCl.
解答 解:A.制备硝基苯的反应为 ,故A错误;
,故A错误;
B.发生的加成反应为CH2═CH2+Br2-→CH2BrCH2Br,故B错误;
C.发生酯化反应为CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,故C错误;
D.发生取代反应为CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl,故D正确;
故选D.
点评 本题考查有机化学反应书写及有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重加成、取代反应的考查,题目难度不大.


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:解答题
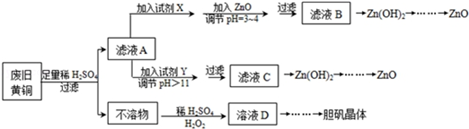
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| s沉淀完全的pH | 3.0 | 8.8 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 大理石和醋酸:CO32-+2H+═H2O+CO2↑ | |
| C. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| D. | 向Ba(OH)2溶液中滴加KHSO4溶液至中性:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮罐贮运浓硫酸 | |
| B. | 铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4 | |
| C. | 金属铝排在金属活动性顺序表中氢元素的前面,铝与强酸反应一定放出氢气 | |
| D. | 将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中不一定有铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL1mol/L氯化镁溶液 | B. | 450mL1.5 mol/L氯酸钾溶液 | ||
| C. | 50mL1.5 mol/L氯化钾溶液 | D. | 50mL0.5 mol/L氯化铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
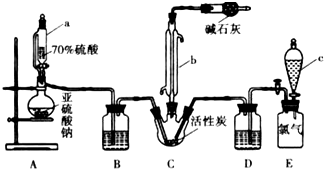 硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示:
硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2L氮气所含的原子数目为NA | |
| B. | 1.7g氨气所含分子数目为0.1NA | |
| C. | 1L 1mol•L-1的Na2SO4溶液中含有Na+的个数为NA | |
| D. | 2g氢气所含氢原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
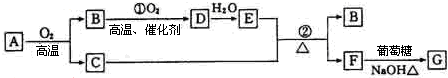
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com