
N2(g)+3H2(g)![]() 2NH3(g)在10L的密闭容器中进行,测得2min内,N2的物质的量由
2NH3(g)在10L的密闭容器中进行,测得2min内,N2的物质的量由
20mol减小到8mol,则2min内N2的反应速率为
| A.1.2mol/(L·min) | B.1mol/(L·min) | C.0.6mol/(L·min) | D.0.4mol/(L·min) |
科目:高中化学 来源: 题型:
氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用。
(1)下图是1mol NO2气体和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2气体和CO反应的热化学方程式: 。

(2)在固定体积的密闭容器中,进行如下化学反应: N2(g)+3H2(g)![]() 2NH3(g);
2NH3(g);
①下列各项能说明该反应一定达到平衡状态的是 (填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(H2)(逆) =)3v(N2)(正)
c.容器内压强保持不变 d.混合气体的密度保持不变
②若上述反应达到平衡时,N2、H2、NH3的浓度之比为1:3:2,再向容器中按物质的量之比为1:3:2通入N2、H2、NH3,与原平衡相比,N2的物质的量浓度 (填增大、不变或减小,下同),NH3的体积分数 。
(3)科学家一直致力研究常温、常压下“人工固氮”的新方法。请回答下列问题:
目前工业合成氨的原理是:N2(g)+3H2(g)![]() 2NH3(g);△H<0。
2NH3(g);△H<0。
①下图表示随条件改变,平衡混合气体中氨气的百分含
量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母序号,下同)_____________;当横坐标为温度时,变化趋势正确的是_________________。

②液氨与水相似,存在着微弱的电离,写出液氨发生电离的方程式: ___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下反应N2(g)+3H2(g) 2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内NH3的反应速率为
A.1.2mol/(L·min) B.1mol/(L·min)
C.0.6mol/(L·min) D.0.4mol/(L·min)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省泉州四校高三第二次联考化学试卷 题型:选择题
合成氨工业对国民经济和社会发展具有重要的意义,对密闭容器中的反应:
N2(g)+3H2(g) 2NH3(g) ;△H< 0 。 400℃、30MPa下n(NH3)和n(H2)随时间变化的关系如图,下列叙述错误的是(
)
2NH3(g) ;△H< 0 。 400℃、30MPa下n(NH3)和n(H2)随时间变化的关系如图,下列叙述错误的是(
)

A.点a的正反应速率比b点的大
B.点c处反应还未达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,500℃下反应至t1时刻, n(H2)比右图中d点的值大
查看答案和解析>>
科目:高中化学 来源:2013届福建省高二上学期期中考试化学试卷 题型:选择题
化学反应N2+3H2=2NH3的能量变化如图所示,E是正值,该反应的热化学方程式是
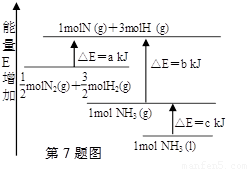
A.N2(g)+3H2(g)=2NH3(1); △H=2(a-b-c)kJ·mol-1
B. N2(g)+3H2(g)=2NH3(g); △H=2(b-a)kJ·mol-1
C.1/2N2(g)+3/2H2(g)=NH3(1); △H=(b+c-a)kJ·mol-1
D.1/2N2(g)+3/2H2(g)=NH3(g); △H=(a+b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2013届湖南师大附中高二12月阶段检测化学试卷 题型:选择题
下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物物质的量时,平衡一定向
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向
正反应方向移动
②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应达平衡时,若减小反应器容积,平衡向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①②④ B.①②③ C.②③④ D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com