
| A. | 糖类是具有甜味的物质 | |
| B. | 糖类是具有Cn(H2O)m通式的物质 | |
| C. | 淀粉是一种白色粉末,本身没有甜味 | |
| D. | 葡萄糖是一种单糖的主要原因是含有醛基 |
分析 A.糖类不一定都具有甜味;
B.鼠李糖不符合通式;
C.并不是所有的糖都有甜味;
D.单糖就是不能再水解的糖类.
解答 解:A.糖类不一定都具有甜味,如纤维素是多糖,但没有甜味,故A错误;
B.有些化合物按其构造和性质应属于糖类化合物,可是它们的组成并不符合Cm(H2O )n通式,如鼠李糖(C6H12O5)、脱氧核糖(C5H10O4)等,故B错误;
C.淀粉没有甜味,水解生成的葡萄糖有甜味,是一种白色粉末,故C正确;
D.单糖就是不能再水解的糖类,葡萄糖不能发生水解反应,故为单糖,与含不含醛基无关,故D错误;
故选C.
点评 本题考查糖类的组成和性质,比较基础,侧重对基础知识的巩固,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:实验题
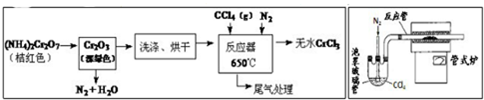
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
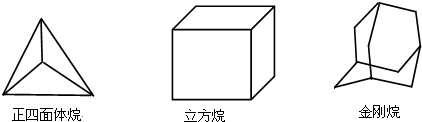
| A. | 2,4,8 | B. | 2,4,6 | C. | 1,3,6 | D. | 1,3,8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

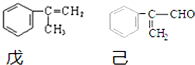
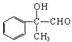
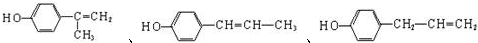 .
.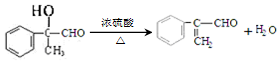 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
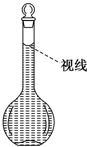 用18mol/L的浓硫酸配制80mL 1.0mol/L的稀硫酸,需用的实验仪器有:A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
用18mol/L的浓硫酸配制80mL 1.0mol/L的稀硫酸,需用的实验仪器有:A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤ | B. | ②③④ | C. | ②③⑤ | D. | ①②⑤ |
查看答案和解析>>
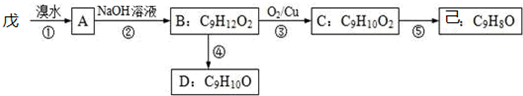
科目:高中化学 来源: 题型:解答题
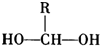 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$ 请根据图作答:
请根据图作答: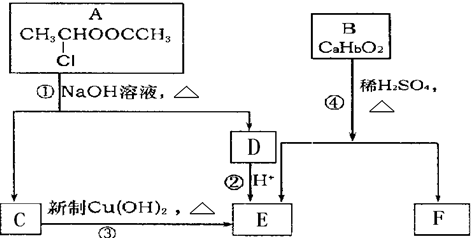

 、
、 、
、 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
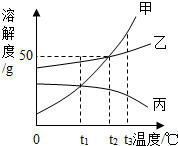
| A. | t1℃时,分别取出相同质量的甲、丙两种饱和溶液升温到t2℃时,甲和乙溶质的质量分数相等 | |
| B. | t2℃时,将甲、乙两种饱和溶液分别恒温蒸发等质量的水,析出晶体的质量可能不等 | |
| C. | 将三种饱和溶液分别从t3℃降低到t2℃时,甲和乙溶质的质量分数减小,丙的溶质的质量分数不变 | |
| D. | 当甲的饱和溶液中含有少量乙时,可以采取冷却热饱和溶液的办法提取乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
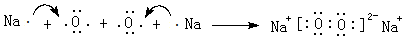 ,工业冶炼单质E的化学方程式2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
,工业冶炼单质E的化学方程式2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com