
| A. | 制取氧气时,用排水法收集氧气出现倒吸现象,立即打开试管上的橡皮塞 | |
| B. | 实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室 | |
| C. | 在气体发生装置上点燃氢气等气体时,必须先检验气体的纯度 | |
| D. | 给试管中的液体加热时,不停沿试管倾斜方向移动试管或加入碎瓷片,以免液体暴沸伤人 |
分析 A.用排水法收集氧气出现倒吸现象,应防止水倒流进入试管中,导致试管炸裂;
B.验结束后将所有的废液,应放在指定废液缸中;
B.可燃性气体不纯,加热易发生爆炸;
D.给试管中的液体加热时,应防止液体剧烈沸腾.
解答 解:A.用排水法收集氧气出现倒吸现象,应防止水倒流进入试管中,导致试管炸裂,则立即打开试管上的橡皮塞,故A正确;
B.验结束后将所有的废液,应放在指定废液缸中,不能倒入下水道排出实验室,会导致地下水污染,故B错误;
B.可燃性气体不纯,加热易发生爆炸,则必须先检验气体的纯度,故C正确;
D.给试管中的液体加热时,应防止液体剧烈沸腾,则加热时不停沿试管倾斜方向移动试管或加入碎瓷片,以免液体暴沸伤人,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯、实验操作、实验安全、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变黄色的溶液:Mg2+、K+、SO42-、NO3- | |
| B. | 使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3- | |
| C. | 无色溶液:Al+、Cl-、SO42-、NO3- | |
| D. | C(H2C2O4)=0.1mol/L溶液:Na+、MnO4-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钙的摩尔质量是74 g•mol-1 | B. | 阿伏加德罗常数是6.02×1023 | ||
| C. | 1 mol H | D. | 1 mol CO约含有6.02×1023个CO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
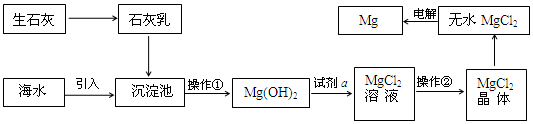
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用溴水除去NaCl溶液中的NaI | |
| B. | 用NaOH溶液与HCl溶液制备NaCl | |
| C. | 用NaOH溶液除去乙酸乙酯中的溴 | |
| D. | 用冷却饱和溶液法提纯含少量NaCl杂质的KNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com