
����Ŀ�����й��ڸ�ͼ��Ľ��ͻ�ó�������ȷ���ǣ� �� 
A.ͼ�ױ�ʾ0.10molL��1NaOH��Һ�ζ�20.00 mL 0.10 molL��1������Һ�ĵζ�����
B.ͼ�ұ�ʾ��������Һ��ͨ�백����������������Һ������I�ı仯
C.����ͼ����ʾ��֪��ʯīת��Ϊ���ʯ����������ʯī�Ƚ��ʯ�ȶ�
D.ͼ����ʾ��Ӧ2SO2+O22SO3 �� t1ʱ��ֻ��С�� SO3��Ũ��
���𰸡�C
���������⣺A������Ϊ���ᣬ0.10 molL��1���ᣬ��pH����1����ͼ�п�ʼpH=1����A����B����������Һ��ͨ�백����Ӧ����ǿ���������泥���������ǿ�������ܽӽ�0����ͼ������B����
C��ʯīת��Ϊ���ʯ������������֪ʯī�����ͣ���ʯī�Ƚ��ʯ�ȶ�����C��ȷ��
D��t1ʱ������Ӧ���ʼ�С��Ȼ����������ܼ�СSO2��Ũ�ȵ�ͬʱ��С�� SO3��Ũ�ȣ���D����
��ѡC��
�����㾫�������ڱ��⿼�������к͵ζ�����Ҫ�˽��к͵ζ�ʵ��ʱ��������ˮϴ���ĵζ������ñ�Һ��ϴ����װ��Һ�����ô���Һ��ϴ������ȡҺ�壻�ζ��ܶ���ʱ�ȵ�һ�����Ӻ��ٶ������۲���ƿ����Һ��ɫ�ĸı�ʱ���ȵȰ������ɫ�����Ϊ�ζ��յ���ܵó���ȷ�𰸣�


 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д� �����ܿ����ϵ�д�
�����ܿ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�ǰ��Ϊǿ����ʣ�����Ϊ������ʵ��ǣ�������
A.���ᡢ�Ȼ�þB.̼�ᡢ̼����
C.̼�����ơ�����D.�������ơ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�����Ȳ��˵������ȷ���ǣ�������
A. ȼ��ʱ��Ũ��ĺ���
B. ��ͨ�����Ը��������Һ������ϩ����Ȳ��
C. Ϊ�˼�����ʯ��ˮ�ķ�Ӧ���ʣ����ñ���ʳ��ˮ������
D. ��Ȳ���ռ�����������ˮ���ռ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�������Һ��ϡ������˵����ȷ���ǣ� ��
A.pH=3�Ĵ�����Һϡ��100����pH=5
B.pH=4��H2SO4��Һ��ˮϡ��100������Һ����ˮ���������c��H+��=1��10��6 molL��1
C.��1L 0.1molL��1��Ba��OH��2��Һϡ��Ϊ2L��pH=13
D.pH=8��NaOH��Һϡ��100������pH=6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǿ��Խ�SiO2�ľ���ṹ����Ϊ�ھ�����Si��Si��֮�����Oԭ�ӡ�����SiO2����ṹͼ,����˵������ȷ����( )
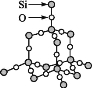
A.ʯӢ������ÿ��Siԭ��ͨ��Si��O���Լ���4��Oԭ������
B.ÿ��Oԭ��Ҳͨ��Si��O���Լ���2��Siԭ������
C.ʯӢ������Siԭ����Oԭ�ӵ�ԭ�Ӹ�����Ϊ1��2,���á�SiO2������ʾʯӢ�����
D.�ھ����д���ʯӢ����,���ܽз���ʽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����0.0500molL��1H2C2O4����Ԫ���ᣩ��Һ�ζ�25.00mL0.1000molL��1NaOH��Һ���õζ�������ͼ������˵����ȷ���ǣ� �� 
A.�����ʾ��Һ�У�c��H+��+c��H2C2O4��+c��HC2O4����=c��OH����
B.�����ʾ��Һ�У�c��HC2O4����+2c��C2O42����=c��Na+��
C.�����ʾ��Һ�У�c��Na+����c��HC2O4������c��H2C2O4����c��C2O42����
D.�ζ������п��ܳ��֣�c��Na+����c��C2O42����=c��HC2O4������c��H+����c��OH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̼�������ﶼ���������⣬Խ��Խ�������ǵ����ӣ���ͼ1�ǵ�Ԫ�صĸ��ּ�̬���������Ķ�Ӧ��ϵ
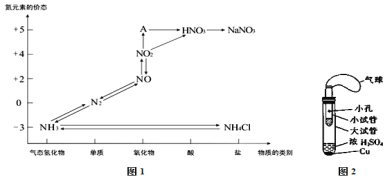
��1������A��Ӧ�Ļ��ϼۺ��������AΪ ��д����ʽ�����Ӻ�Ԫ�صĻ��ϼ��ܷ����仯�ĽǶ��жϣ�ͼ1�м������������л�ԭ�ԵĻ������� ��
��2��Ũ��ϡ����������������в����Ҫ��ȥ����Ʒ�����ͭ�Ʋ�Ӧѡ��Ӧ�Ļ�ѧ����ʽΪ ��
��3��ijͬѧ�������ͼ2��ʾ����ʵ��װ�ã�����װ��δ���������Ʊ�SO2��������ʵ�������������仹ԭ�ԣ��Ʊ�SO2ʱѡ�õ��Լ�ΪCu��ŨH2SO4���ش��������⣮
��д����ȡSO2�Ļ�ѧ����ʽ ��
�ڸ�ͬѧ����ʵ������������SO2�Ļ�ԭ�ԣ���ѡ�õ��Լ�Ϊ ��
A ˫��ˮ��H2O2�� BƷ����Һ C ���Ը��������Һ
��4����ҵ�ϰѺ�ˮ�Ƚ����������������壬�ﵽ�������Ŀ�ģ����չ��ճ��õķ��������ȿ�������Br2����SO2����Br2��ȡ���պ����Һ�������м����Ȼ�����Һ�а�ɫ����������д��SO2����Br2��Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ�ζ�ԭ��ͬ�к͵ζ�ԭ�����ƣ�Ϊ�˲ⶨijδ֪Ũ�ȵ�NaHSO3��Һ��Ũ�ȣ�����0.1000mol/L������KMnO4��Һ���еζ����ش��������⣺
��1����ƽ���ӷ���ʽ��MnO4��+HSO3��+H+����Mn2++SO42��+H2O
��2����KMnO4���еζ�ʱ��KMnO4��ҺӦװ���У��жϵζ��յ�������� ��
��3�����в����ᵼ�²ⶨ���ƫ�ߵ���
A.δ�ñ�Ũ�ȵ�����KMnO4��Һ��ϴ�ζ���
B.ʢװδ֪Һ����ƿ������ˮϴ����δ�ô���Һ��ϴ
C.�ζ�ǰ�ζ��ܼ��첿��������
D.�۲����ʱ���ζ�ǰ���ӣ��ζ�����
��4�������±��вⶨ��ʵ�����ݣ�����KMnO4��Һ�����ƽ��ֵΪmL��NaHSO3��Һ�����ʵ���Ũ��Ϊmol/L�����ݾ�ȷ��0.1��
ʵ���� | ����NaHSO3��Һ�����/mL | KMnO4��Һ�����/mL |
1 | 20.00 | 15.98 |
2 | 20.00 | 17.00 |
3 | 20.00 | 16.02 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��2KMnO4+16HCl�T2KCl+2MnCl2+5Cl2��+8H2O K2Cr2O7+14HCl�T2KCl+2CrCl3+3Cl2��+7H2O
MnO2+4HCl ![]() MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O
���У�KMnO4��һ��Ũ�ȵ����ᷴӦ��K2Cr2O7��ͽ�Ũ������ ����6molL��1����Ӧ��MnO2���Ũ���ᣨ��8molL��1����Ӧ��
���½����У�����ȷ���ǣ� ��
A.������Ӧ������������ԭ��Ӧ�����������ӷ�Ӧ
B.����1 mol Cl2ת�Ƶ�������Ϊ2 NA��NAΪ�����ӵ�������
C.�����ԣ�KMnO4��K2Cr2O7��Cl2��MnO2
D.�����Ũ��Խ��Cl���Ļ�ԭ��Խǿ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com