
分析 根据反应“Zn+2FeCl3═ZnCl2+2FeCl2”可知,反应中Zn被氧化,应为原电池负极,失电子而被氧化,
正极应为活泼性比Zn弱的金属或非金属材料,Fe3+在正极得到电子而被还原,电解质溶液为FeCl3,以此画出实验装置图并书写有关的电极反应式.
解答 解:(1)由反应“Zn+2FeCl3═ZnCl2+2FeCl2”可知,反应中Zn被氧化,应为原电池负极,失电子而被氧化,
正极应为活泼性比Zn弱的金属或非金属材料,Fe3+在正极得到电子而被还原,电解质溶液为FeCl3,实验装置图: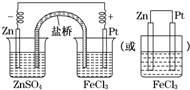 ,
,
故答案为: ;
;
(2)正极为Pt(或石墨),三价铁离子在正极得电子发生还原反应,电极反应式为Fe3++e-=Fe2+,负极为活泼金属锌,失电子发生氧化反应,电极反应为Zn-2e-=Zn2+,故答案为:Pt(或石墨);Fe3++e-═Fe2+;Zn;氧化反应;
(3)原电池工作时,电子从负极流出,沿导线流向正极,故答案为:负(Zn);正(Pt或石墨).
点评 本题考查原电池的设计及原电池的工作原理,题目难度不大,注意从氧化还原反应的角度由电池反应判断电极反应.


科目:高中化学 来源: 题型:解答题
 锰及其化合物有广泛应用.
锰及其化合物有广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与铁粉 | B. | 二氧化碳与石灰水 | ||
| C. | 锌与硫酸 | D. | 碳酸钠与硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
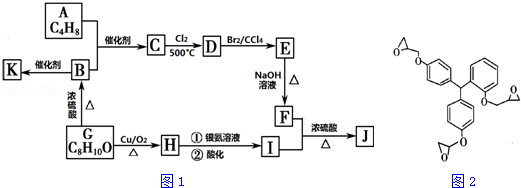
 .
. ;F+I→J
;F+I→J .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
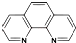 ),它能与Fe2+形成红色配合物(如图甲),该配离子中Fe2+与氮原子形成配位键共有6个.
),它能与Fe2+形成红色配合物(如图甲),该配离子中Fe2+与氮原子形成配位键共有6个.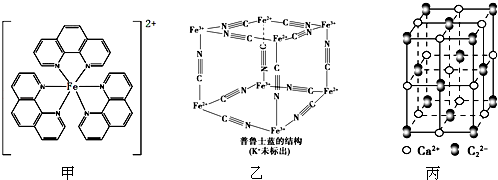
 ,其中σ键与π键数目之比为1:2.
,其中σ键与π键数目之比为1:2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 | |
| B. | 将NH4Cl溶液蒸干制备NH4Cl固体 | |
| C. | 因为NH3能使酚酞溶液变红,NH3用于设计喷泉实验 | |
| D. | 浓氨水可检验氯气管道是否漏气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com