
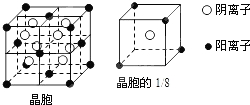
分析 B、C、D的最高价氧化物的水化物均能互相反应生成盐和水,说明含有两性氢氧化物,根据B、C、D同周期可判断B为Na元素,C为Al元素,E和其它元素既不在同周期也不在同主族且原子序数最大,应为第四周期元素,前20号元素中只有Ca符合,故E为Ca.根据$\frac{1}{8}$晶胞可知:含有Ca的个数为4×$\frac{1}{8}$=$\frac{1}{2}$,含有A的个数为1,故A和E可形成离子化合物的化学式为EA2,则A的化合价为-1价,应为H、F、Cl等元素中的一种,根据A、D同主族可知A为F,D为Cl元素,再结合物质结构、性质解答.
解答 解:B、C、D的最高价氧化物的水化物均能互相反应生成盐和水,说明含有两性氢氧化物,根据B、C、D同周期可判断B为Na元素,C为Al元素,E和其它元素既不在同周期也不在同主族且原子序数最大,应为第四周期元素,前20号元素中只有Ca符合,故E为Ca.根据$\frac{1}{8}$晶胞可知:含有Ca的个数为4×$\frac{1}{8}$=$\frac{1}{2}$,含有A的个数为1,故A和E可形成离子化合物的化学式为EA2,则A的化合价为-1价,应为H、F、Cl等元素中的一种,根据A、D同主族可知A为F,D为Cl元素,
(1)通过以上分析知,A、C、D、E依次是F、Al、Cl、Ca,
故答案为:F、Al、Cl、Ca;
(2)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,同一主族中,元素的第一电离能随着原子序数的增大而减小,所以A、B、C、D四种元素的第一电离能最小的是Na元素,元素的非金属性越强其电负性越强,所以电负性最大的是F元素,原子的电子层数越多其原子半径越大,同一周期元素中,原子半径随着原子序数的增大而减小,所以其原子半径大小顺序是F<Cl<Al<Na,
故答案为:Na; F;F<Cl<Al<Na;
(3)A、D的氢化物分别是HF、HCl,因为HF中存在氢键导致HF的沸点较高,
故答案为:因为HF分子间存在氢键;
(4)A为F,E为Ca,在氟化钙晶体中,以晶胞顶点钙离子为例,与它最近且等距离的钙离子分布在经过该顶点的12个面的面心上,所以共有12个,
故答案为:12.
点评 本题考查了元素位置结构性质的相互关系及应用,涉及元素推断、晶体的计算、元素周期律等知识点,根据原子结构、物质性质确定元素,再结合均摊法、元素周期律等知识点来分析解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ①③④ | C. | ②④⑥ | D. | ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率是指一定时间内任何一种反应物浓度的减小或任何一种生成物浓度的增加 | |
| B. | 化学反应速率为0.8 mol/(L•s)是指1s时某物质的浓度为0.8mol/L | |
| C. | 根据化学反应速率的大小可以知道化学反应的相对快慢 | |
| D. | 对于任何化学反应来说,反应速率越大,反应现象越明显 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼热的炭与二氧化碳反应 | |
| B. | 铁和稀硫酸的反应 | |
| C. | 氢氧化钡晶体的粉末和氯化铵晶体混合 | |
| D. | 生石灰溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com