
【题目】实验室用图示装置制备KC1O溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4。
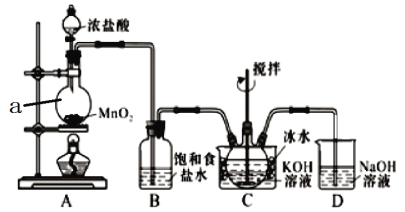
(査阅资料)① Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;② K2FeO4易溶于水,微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
(1)仪器a的名称是_________;装置A中反应的化学方程式为__________________。
(2)装置C中三颈烧瓶置于冰水浴中的目的是_________________________________。
(3)装置B吸收的气体是_________,装置D的作用是___________________________。
(4)C中得到足量KC1O后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为__________________________。
(5)往(4)所得溶液中加入饱和KOH溶液,冷却至0℃~5℃析出紫黑色晶体,过滤,得到K2FeO4粗产品。K2FeO4粗产品含有KCl等杂质,进一步提纯方法是___________。
(6)若实验中消耗了VmL c mol/L的Fe(NO3)3溶液,Fe(NO3)3充分反应,最终制得a g的K2FeO4固体,则本实验K2FeO4的产率为 ______________(列出算式即可)。
【答案】圆底烧瓶 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 提高KClO的产率,防止Cl2与KOH反应生成KC1O3 HCl 吸收Cl2,防止污染空气 3C1O+2Fe3++10OH=2FeO42-+3Cl+5H2O 重结晶
MnCl2+Cl2↑+2H2O 提高KClO的产率,防止Cl2与KOH反应生成KC1O3 HCl 吸收Cl2,防止污染空气 3C1O+2Fe3++10OH=2FeO42-+3Cl+5H2O 重结晶 ![]()
【解析】
(1)装置A是实验室制取氯气的装置,按实验室制取氯气的有关原理回答;
(2)Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;
(3)制取氯气中含有HCl,装置B吸收的气体是HCl,装置D的作用是尾气吸收;
(4)KC1O加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5h,生成K2FeO4和H2O,则KClO被还原成KCl,利用得失电子守恒、电荷守恒等配平书写离子方程式;
(5)K2FeO4和KCl均易溶于水,K2FeO4粗产品含有KCl等杂质,应用重结晶的方法分离;
(6)依据Fe守恒,计算产率。
(1)装置A是实验室制取氯气的装置,a是圆底烧瓶,A中发生的反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
本题答案为:圆底烧瓶 、MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(2)Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3,所以为了提高KClO的产率,防止Cl2与KOH反应生成KC1O3,C中三颈烧瓶置于冰水浴中;
本题答案为:提高KClO的产率,防止Cl2与KOH反应生成KC1O3。
(3)制取氯气中含有HCl,装置B吸收的气体是HCl,装置D的作用是吸收Cl2,防止污染空气;
本题答案为:HCl 、 吸收Cl2,防止污染空气。
(4)KC1O加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5h,生成K2FeO4和H2O,则KClO被还原成KCl,根据得失电子守恒、电荷守恒等配平的离子方程式为:3C1O+2Fe3++10OH=2FeO42-+3Cl+5H2O;
本题答案为:3C1O+2Fe3++10OH=2FeO42-+3Cl+5H2O。
(5)K2FeO4和KCl均易溶于水,K2FeO4粗产品含有KCl等杂质,应用重结晶的方法分离提纯K2FeO4;
本题答案为:重结晶。
(6)依据反应过程中Fe守恒,设生成K2FeO4的物质的量为x,
则有:Fe(NO3)3![]() K2FeO4
K2FeO4
1 1
V![]() cmol x
cmol x
解得:x= V![]() cmol,m(K2FeO4)= V
cmol,m(K2FeO4)= V![]() cmol
cmol![]() 198g/mol=0.198Vg,则本实验K2FeO4的产率为:
198g/mol=0.198Vg,则本实验K2FeO4的产率为:![]() 100
100![]() ;
;
本题答案为:![]() 100
100![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】乙烷中混有乙烯,欲除去乙烯得到纯净的乙烷气体,最好依次通过哪一组试剂
A. 澄清石灰水、浓硫酸
B. 酸性高锰酸钾溶液、浓硫酸
C. 溴水、浓硫酸
D. 足量氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,1-二环丙基乙烯(![]() )是重要医药中间体,下列关于该化合物的说法错误的是
)是重要医药中间体,下列关于该化合物的说法错误的是
A. 所有碳原子不能在同一平面 B. 能被酸性髙锰酸钾溶液氧化
C. 二氯代物只有3种 D. 生成1 molC8H18至少需要3molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛在木材加工、医药等方面有重要用途。甲醇直接脱氢是工业上合成甲醛的新方法,制备过程涉及的主要反应如下:
反应I:CH3OH(g)![]() HCHO(g)+H2(g) △H1=+85.2kJ·mol-1
HCHO(g)+H2(g) △H1=+85.2kJ·mol-1
反应II:CH3OH(g)+1/2O2(1)![]() HCHO(g)+H2O(g) △H2
HCHO(g)+H2O(g) △H2
反应III:H2(g)+1/2O2(g)![]() H2O(g) △H3=-241.8kJ·mol-1
H2O(g) △H3=-241.8kJ·mol-1
副反应:
反应IV:CH3OH(g)+O2(g)![]() CO(g)+2H2O(g) △H4=-393.0kJ·mol-1
CO(g)+2H2O(g) △H4=-393.0kJ·mol-1
(1)计算反应Ⅱ的反应热△H2=____________________________________________。
(2)750K下,在恒容密闭容器中,发生反应CH3OH(g)![]() HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=___________(用含P0和α的式子表示);当P0=101kPa,测得α=50.0%,计算反应平衡常数Kp=___________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=___________(用含P0和α的式子表示);当P0=101kPa,测得α=50.0%,计算反应平衡常数Kp=___________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
(3)Na2CO3是甲醇脱氢制甲醛的催化剂,有研究指出,催化反应的部分机理如下:
历程i:CH3OH→H+·CH2OH
历程ⅱ:·CH2OH→·H+HCHO
历程ⅲ:·CH2OH→3·H+CO
历程iv:·H+·H→H2
下图表示一定条件下温度对碳酸钠催化脱氢性能的影响,回答下列问题:
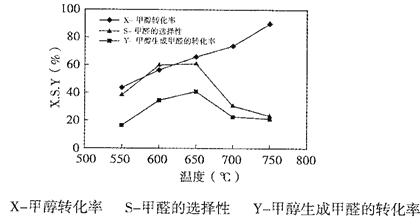
①从平衡角度解析550℃-650℃甲醇生成甲醛的转化率随温度升高的原因___________;
②反应历程i的活化能___________(填“>、“<”或“=”)CH3OH(g)![]() HCHO(g)+H2(g)活化能。
HCHO(g)+H2(g)活化能。
③650℃~750℃,反应历程ii的速率___________(填“>”、“<”或“=”)反应历程ⅲ的速率。
(4)吹脱是处理甲醛废水的一种工艺,吹脱速率可用方程v=0.0423c(mg·L-1·h-1)表示(其中c为甲醛浓度),下表为常温下甲醛的浓度随吹脱时间变化数据。
浓度(mg/L) | 10000 | 8000 | 4000 | 2000 | 1000 |
吹脱时间(h) | 0 | 7 | 23 | 39 | 55 |
则当甲醛浓度为2000mg/L时,其吹脱速率v=___________ mg·L-1·h-1,分析上表数据,起始浓度为10000mg/L,当甲醛浓度降为5000mg/L,吹脱时间为___________h。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置测定中和热的实验步骤如下:

①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液的最高温度。
回答下列问题:
(1)仪器A的名称为_________________________。
(2)倒入NaOH溶液的正确操作是________。
A.沿玻璃缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是________。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
温度 实验 次数 | 起始温度t1/℃ | 终止 温度 t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | _______ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似地认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),则中和热ΔH = ______ (取小数点后一位)。
③中和热测定实验中,下列操作一定会降低实验准确性的是________。
A.用滴定管(精量仪器,读数保留到0.01)取所用酸碱溶液的体积
B.NaOH溶液在倒入小烧杯时,有少量溅出
C.大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
D.测量HCl溶液的温度计用水洗净后才用来测NaOH溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。

Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率。
(1)写出该反应的离子方程式 ___________________________________________________;为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是______________;除如图所示的实验用品、仪器外,还需要的一件实验仪器是__________________。
(2)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是____________________________________________。
(3)试简述测定该反应的化学反应速率的其他方法:_______________________________________________(写一种)。
Ⅱ.为探讨化学反应速率的影响因素,某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。
(4)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
实验编号 | T/K | 大理石规格 | HNO3浓度/mol·L-1 | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和______探究温度对该反应速率的影响; (Ⅲ)实验①和______探究大理石规格(粗、细)对该反应速率的影响。 |
② | _______ | 粗颗粒 | ______ | |
③ | ____ | ___ | 2.00 | |
④ | 298 | ________ | _____ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
温度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①写出工业合成氨的化学方程式_________。
②由上表数据可知该反应为放热反应,理由是_________。
③理论上,为了增大平衡时H2的转化率,可采取的措施是_________。(填序号)
a. 增大压强 b. 使用合适的催化剂
c. 升高温度 d. 及时分离出产物中的NH3
(2)原料气H2可通过反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
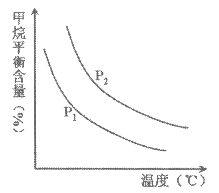
①图中,两条曲线表示压强的关系是:P1_____P2(填“>”、“=”或“<”)。
②该反应为________反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)获取。T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1
CO(g)+3H2(g)获取。T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1
①平衡时CO的转化率为_________。
②该温度下反应的平衡常数K值为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—铜空气燃料电池(如图)容量高、成本低,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法错误的是

A. 整个反应过程中,氧化剂为O2
B. 放电时,正极的电极反应式为:Cu2O+H2O+2e-=2Cu+2OH-
C. 放电时,当电路中通过0.1 mol电子的电量时,有0.1 mol Li+透过固体电解质向Cu极移动,有标准状况下1.12 L氧气参与反应
D. 通空气时,铜被腐蚀,表面产生Cu2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z在元素周期表中的位置如右下图所示,下列说法正确的是 ( )

A. X、Y、Z三种元素中,X的非金属性最强
B. 常压下X的单质的熔点比Z的低
C. Y的最高正化合价为+7
D. Y的氢化物的稳定性比Z的弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com