
【题目】下列物质的转化在给定条件下能实现的是( )
A. NH3![]() NO2
NO2![]() HNO3B. Al
HNO3B. Al![]() NaAlO2(aq)
NaAlO2(aq)![]() NaAlO2(s)
NaAlO2(s)
C. Fe![]() Fe2O3
Fe2O3![]() FeD. AgNO3(aq)
FeD. AgNO3(aq)![]() [Ag(NH3)2OH(aq)]
[Ag(NH3)2OH(aq)]![]() Ag
Ag
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+)=lgc(Ba2+),p(SO42)=lgc(SO42)。下列说法正确的是
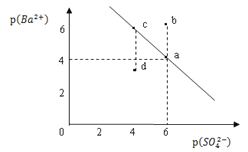
A. 该温度下,Ksp(BaSO4)=1.0×1024
B. 加入BaCl2可以使溶液由c点变到a点
C. d点表示的是该温度下BaSO4的不饱和溶液
D. a点的Ksp(BaSO4)小于b点的Ksp(BaSO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系。据此判断下列说法正确的是
A. 石墨转变为金刚石的反应是吸热反应
B. 白磷比红磷稳定
C. S(g)=S(s) ΔH>0
D. H2(g)+I2(g)![]() 2HI(g) ΔH>0
2HI(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定。

(1)该学习小组按上图装置进行实验(部分夹持装置省去),反应一段时间后,分别取B、C瓶中的溶液进行实验,实验现象如下表。
已知:①饱和NaClO溶液pH为11;
②25°C时,弱酸电离常数为:H2CO3:K1=4.4×10-7,K2=4.7×10-11;HClO:K=3×10-8
实验步骤 | 实验现象 | |
B瓶 | C瓶 | |
实验1:取样,滴加紫色石蕊试液 | 变红,不褪色 | 变蓝,不褪色 |
实验2:测定溶液的pH | 3 | 12 |
回答下列问题:
①仪器a的名称___________,装置A中发生反应的离子方程式__________。
②C瓶溶液中的溶质是NaCl、__________(填化学式)。
③若将C瓶溶液换成NaHCO3溶液,按上述操作步骤进行实验,C瓶现象为:实验1中紫色石蕊试液立即褪色;实验2中溶液的pH=7.结合平衡移动原理解释紫色石蕊试液立即褪色的原因______
(2)测定C瓶溶液中NaClO含量(单位:g/L)的实验步骤如下:
Ⅰ.取C瓶溶液20mL于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液,淀粉溶液显示终点后,重复操作2~3次,Na2S2O3溶液的平均用量为24.00mL。(已知:I2+2S2O32-=2I-+S4O62-)
①步骤I的C瓶中发生反应的离子方程式为_________。
②盖紧瓶塞并在暗处反应的原因__________滴定至终点的现象_____________。
③C瓶溶液中NaClO含量为______g/L(保留2位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置或操作进行相应实验,能达到实验目的的是( )
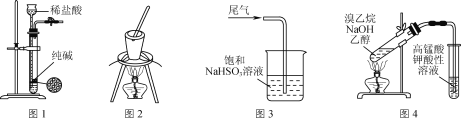
A. 用图1所示装置制取少量纯净的CO2气体
B. 用图2所示装置灼烧碎海带
C. 用图3所示装置吸收尾气中的SO2
D. 用图4所示装置检验溴乙烷与NaOH醇溶液共热产生的乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应。

据图回答下列问题:
(1)写出A、C、D的结构简式:
A________,C________,D________。
(2)写出①②两步反应的化学方程式,并注明反应类型:
①________________________________(反应类型____________)。
②________________________________(反应类型____________)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是甲、乙、丙三位同学制取乙酸乙酯的实验过程,请完成相关问题。
(实验目的)制取乙酸乙酯
(实验原理)甲、乙、丙三位同学均采用乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯
(装置设计)甲、乙、丙三位同学分别设计了下列三套实验装置:

请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,较合理的是________(填“甲”或“乙”)。丙同学将甲装置进行了改进,将其中的玻璃导管改成了球形干燥管,除起冷凝作用外,另一重要作用是________________。
(实验步骤)
(1)按所选择的装置组装仪器,在试管中先加入3mL乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2mL冰醋酸,加入2~3块碎瓷片;
(2)将试管固定在铁架台上;
(3)在试管②中加入适量的饱和Na2CO3溶液;
(4)用酒精灯对试管①加热;
(5)当观察到试管②中有明显现象时停止实验。
(问题讨论)
a.步骤(1)组装实验装置,加入药品前还应检查________;
b.写出试管①中发生反应的化学方程式(注明反应条件):________________;
c.试管②中饱和Na2CO3溶液的作用是________________;
d.从试管②中分离出乙酸乙酯的实验操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列说法正确的是( )
A. 0.1molCH4和0.1molCl2充分反应,生成的C-Cl键和H-Cl键的数目均为0.2NA
B. 7.8gNa2S和Na2O2的混合物中所含阴离子的数目等于0.2NA
C. 18g固态水(冰)中含有的氢键的数目为2NA
D. 25℃时,Ksp(AgI)=1.0×10-16,则AgI饱和溶液中Ag+数目为1.0×10-8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由相同金属电极及其不同浓度的盐溶液组成的电池,称浓差电池,电子由溶液浓度较小的一极流向浓度较大的一极。如图所示装置中,X电极与Y电极初始质量相等。进行实验时,先闭合K2,断开K1,一段时间后,再断开K2,闭合K1,即可形成浓差电池,电流计指针偏转。下列不正确的是( )
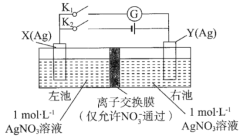
A. 充电前,该电池两电极存在电势差
B. 放电时,右池中的NO3-通过离了交换膜移向左池
C. 充电时,当外电路通过0.1 mol电子时,两电极的质量差为21.6g
D. 放电时,电极Y为电池的正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com