
分析 醇X蒸气的密度是相同条件下氢气密度的37倍,则X的相对分子质量为74,1.48gX的物质的量为$\frac{1.48g}{74g/mol}$=0.02mol,产生的气体依次通过浓硫酸和碱石灰,使两者的质量分别增加1.80g和3.52g.可知n(H2O)=$\frac{1.80g}{18g/mol}$=0.1 mol,n(CO2)=$\frac{3.52g}{44g/mol}$=0.08 mol,以此解答该题.
解答 解:(1)醇X蒸气的密度是相同条件下氢气密度的37倍,则X的相对分子质量为74,摩尔质量为74g/mol,故答案为:74g/mol;
(2)设醇的分子式为CxHyOz,
n(CxHyOz)=$\frac{1.48g}{74g/mol}$=0.02 mol,
知n(H2O)=$\frac{1.80g}{18g/mol}$=0.1 mol,0.02 y=0.1×2,y=10,
n(CO2)=$\frac{3.52g}{44g/mol}$=0.08 mol,0.02 x=0.08,x=4,
12x+y+16z=74,z=1,
醇的分子式为C4H10O,
故答案为:C4H10O;
(3)X所有可能的结构简式为CH3CH2CH2CH2OH、CH3CHOHCH2CH3、(CH3)2CHCH2OH、(CH3)3COH,
故答案为:CH3CH2CH2CH2OH、CH3CHOHCH2CH3、(CH3)2CHCH2OH、(CH3)3COH.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,明确常见有机物结构与性质为解答关键,注意相对密度的运用.


科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸不能盛放在玻璃试剂瓶中 | |
| B. | 玻璃、水晶、陶瓷的主要成分均是硅酸盐 | |
| C. | 灼烧NaOH固体时不能使用瓷坩埚,因为坩埚中的SiO2能与NaOH反应 | |
| D. | 由沙子制备光伏材料时的反应之一为SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a点溶液A、B的物质的量浓度相等 | |
| B. | 通常采用降温结晶的方法获得晶体B | |
| C. | 用蒸发浓缩、趁热过滤从C的溶液中分离出晶体C | |
| D. | 30℃时,A的饱和溶液的质量分数约为35% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 仪器 | 试剂 | 实验目的 |
| A | 托盘天平(带砝码)、滴管、量筒、烧杯、药匙、玻璃棒 | 食盐,蒸馏水 | 配制一定物质的量浓度的NaCl溶液 |
| B | 烧杯、漏斗、滴管、铁架台(带铁圈)、玻璃棒、滤纸、导气管 | 烧碱,CO2,稀盐酸 | 除去AlCl3溶液中少量的MgCl2 |
| C | 酸式滴定管、滴管、铁架台(带铁夹) | 已知浓度的盐酸、石蕊 | 测定NaOH溶液的浓度 |
| D | 分液漏斗、烧瓶、锥形瓶、导管、橡皮塞 | 稀盐酸,大理石,硅酸钠溶液 | 证明非金属性:Cl> C>Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,它不可能具有的性质是( )
,它不可能具有的性质是( )| A. | ①④ | B. | ①②⑥ | C. | ①⑤ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. |  图中曲线表示反应2SO2 (g)+O2 (g)?2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. |  表示10 mL 0.01 mol•L-1KMnO4 酸性溶液与过量的0.1 mol•L-1H2 C2 O4溶液混合时,n(Mn2+) 随时间的变化 | |
| D. | 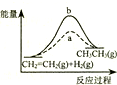 图中a、b曲线分别表示反应CH2=CH2 (g)+H2 (g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com