

��1���ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�� ���塣ij�ϳɰ���ҵ����������Ȼ����ˮ��Ӧ�Ʊ�������Ҫ��ӦΪ��
CH4 (g)+ 2H2O (g)  CO2(g)+4H2 (g)
CO2(g)+4H2 (g)
��Ӧ�����������仯��ͼ��ʾ����÷�ӦΪ__________��Ӧ������ȡ����ȡ���
��2��ij�¶��£�10L�ܱ������г���2mol CH4�� 3molH2O(g)������CH4 (g)+ 2H2O (g)  CO2(g)+4H2 (g)��Ӧ����Ӧ���е�4sʱCO2 �����ʵ���Ũ��Ϊ0.08mol/L���ٹ�һ��ʱ�䷴Ӧ��ƽ�⣬ƽ��ʱ������ѹǿ����ʼʱ��1.4������
CO2(g)+4H2 (g)��Ӧ����Ӧ���е�4sʱCO2 �����ʵ���Ũ��Ϊ0.08mol/L���ٹ�һ��ʱ�䷴Ӧ��ƽ�⣬ƽ��ʱ������ѹǿ����ʼʱ��1.4������
��ǰ4s��CH4Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ���٣�
�� 4sʱ�����������H2���������Ϊ���٣�
��ƽ��ʱ��H2O (g)��Ũ���Ƕ��٣���Ҫ��д��������̣�

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����й�������ȷ����(����)
A���Ȼ��Ƶ�ˮ��Һ�ܵ��磬ʳ��ˮ�ǵ����
B��������ˮ��Һ�ܵ��磬�������Ƿǵ����
C��H2SO4Һ̬ʱ�����磬���Ƿǵ����
D��MgCl2������״̬�¿ɵ��磬���ǵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��Һ���ܺ������������еļ���(��������Һ������H����OH��)��Na����NH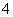 ��SO
��SO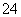 ��CO
��CO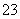 ��NO
��NO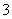 ��ȡ200 mL����Һ��������ֳ����ݣ��ֱ�������ʵ�顣
��ȡ200 mL����Һ��������ֳ����ݣ��ֱ�������ʵ�顣
ʵ��һ����һ�ݼ��������ռ���ȣ������������ڱ�״����Ϊ224 mL��
ʵ������ڶ����ȼ������������ᣬ�������ټ�������BaCl2��Һ���ó���2.33 g��
����˵����ȷ����(����)
A������Һ���ܺ���Na��
B������Һһ������NH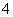 ��SO
��SO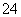 ��CO
��CO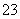 ��NO
��NO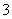
C������Һһ��������NO
D������Һһ������Na������c(Na��)��0.1 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ϵ�ر�����м��д��������ⱻ�ᵽ�����ճ̣�����Ҫԭ����
A�����õ����ǵĽ�������
B���������е�ʯī�缫
C����ֹ����еĹ����Ӻ�Ǧ���ؽ������Ӷ�������ˮ����Ⱦ
D����ʹ�������й�ĵ��Һ��ʴ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
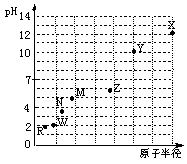
��ͼ�ǵ�������Ԫ�ص�����������ˮ����ij��ͬŨ��ϡ��Һ��pH��ԭ�Ӱ뾶�Ĺ�ϵʾ��ͼ��������˵����ȷ����
A��ԭ��������X��Z��W
B����̬�⻯����ȶ��ԣ�N��R
C��Y��W�γɹ��ۻ�����
D��X��Z��������������Ӧ��ˮ��������� Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪��Ӧ����101 kPaʱ��2C(s)��O2(g)===2CO(g)����H����221 kJ/mol
��ϡ��Һ�У�H��(aq)��OH��(aq)===H2O(l)
��H����57.3 kJ/mol���н�����ȷ����(����)
A��̼��ȼ���ȵ���ֵ����110.5 kJ/mol
B���ٵķ�Ӧ�Ȧ�HΪ221 kJ/mol
C��Ũ������ϡNaOH��Һ��Ӧ���к���Ϊ��57.3 kJ/mol
D��ϡ������ϡNaOH��Һ��Ӧ����1 molˮ���ų�57.3 kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪1 mol����ת��Ϊ1 mol���ף�����18.39 kJ������
��4P(�죬s)��5O2(g)===2P2O5(s)����H1
��P4(�ף�s)��5O2(g)===2P2O5(s)����H2
��H1�릤H2�Ĺ�ϵ��ȷ����(����)
A����H1����H2������������ B����H1>��H2
C����H1<��H2 D����ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪�к��ȵ���ֵ��57.3 kJ��mol�C1���������ʷ�Ӧʱ������57.3 kJ��������( )
A��ϡHCl��ϡNaOH
B��1.0 mol��L�C1 HCl��1.0 mol��L �C1 NaOH
C��500 mL 2.0 mol��L-1 HCl��500 mL2.0 mol��L �C1 NaOH
D��500 mL 2.0 mol��L�C1 H2SO4��500 mL 2.0 mol��L�C1 Ba(OH)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��a��b��c��d�ĸ������缫���йصķ�Ӧװ�ü������������£�

�ɴ˿��ж������ֽ����Ļ��˳���� ( )
A��a>b>c>d B��b>c>d>a C��d>a>b>c D�� a>b>d>c
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com