
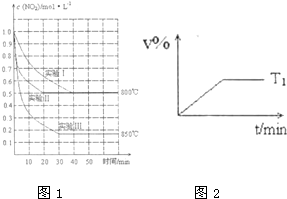
 体积为2L的密闭容器中反应2NO2(g)?2NO(g)+O2(g)在三种不同条件下进行,其中实验I、II都在800℃、实验III在850℃;NO、O2的起始浓度都为0,NO2 的浓度随时间的变化如图所示.请回答下列问题:
体积为2L的密闭容器中反应2NO2(g)?2NO(g)+O2(g)在三种不同条件下进行,其中实验I、II都在800℃、实验III在850℃;NO、O2的起始浓度都为0,NO2 的浓度随时间的变化如图所示.请回答下列问题: ,
, ;
; 2NO(g)+O2(g)
2NO(g)+O2(g)| 0.25×0.52 |
| 0.52 |
| 1mol |
| 2L |
| 1mol |
| 2L |
| 0.25×12 |
| 12 |
| 1 |
| 4 |
| 1 |
| 4 |
| 1 |
| 5 |


科目:高中化学 来源: 题型:
| A、常温常压下,0.17g NH3中含有的共用电子对数为0.1NA |
| B、常温常压下,1 L pH=1的稀H2SO4中含有的氢离子数为0.1NA |
| C、标准状况下,2.24 L Cl2与足量稀NaOH反应转移电子数为0.1NA |
| D、10 g由CaCO3与KHCO3组成的混合物中含有的碳原子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量浓度相同时,各溶液的pH关系为pH(Na2Y)>pH(NaX)>pH(NaHY) |
| B、a mol/L HX溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(X-),则不一定a<b |
| C、在HX溶液中滴入Na2Y溶液,反应2HX+Y2-═2X-+H2Y成立 |
| D、若0.1 mol/L NaHY溶液呈酸性,则其水解能力小于电离能力 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、MnO-4>Fe3+>Cl2>I2 |
| B、Cl2>I2>Fe3+>MnO4 |
| C、MnO-4>Cl2>Fe3+>I2 |
| D、Fe3+>MnO-4>Cl2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | ||||
| 装置 |  |
 |
 |
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硅酸钠溶液的保存和碱溶液一样,存放在橡胶塞密封的广口试剂瓶中 |
B、 用如图所示操作配制浓硫酸和浓硝酸的混酸 |
| C、用移液管取液后,将移液管垂直放入稍倾斜的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管 |
| D、欲分离硝酸钾和氯化钠的混合物(物质的量比为1:1),先将样品溶解,然后加热至溶液表面出现晶膜后冷却,过滤得硝酸钾晶体;将滤液加热至有大量晶体析出后,用余热蒸干,得氯化钠晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为配制250mL 0.2mol/L Na2CO3溶液的示意图.
如图为配制250mL 0.2mol/L Na2CO3溶液的示意图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com