
| A. | 7 g | B. | 14 g | C. | 28 g | D. | 无法计算 |
分析 反应中硝酸体现两种性质,一是酸性,以NO3-离子存在溶液中,另一种是氧化性,被还原为NO;由于硝酸恰好反应,且在所得溶液中加入KSCN溶液,无血红色出现,则反应后生成了硝酸亚铁,根据N原子守恒计算出硝酸亚铁的物质的量,再根据铁元素守恒计算出用CO还原可得铁的物质的量及质量.
解答 解:标况下1.12LNO的物质的量为:$\frac{1.12L}{22.4L/mol}$=0.05mol,
150 mL 2 mol•L-1的HNO3溶液中含有硝酸的物质的量为:2mol/L×0.15L=0.3mol,
由于硝酸恰好反应,且在所得溶液中加入KSCN溶液,无血红色出现,则反应后生成了硝酸亚铁,
根据N原子守恒,生成硝酸亚铁的物质的量为:$\frac{1}{2}$(0.3mol-0.05mol)=0.125mol,
即:原混合物中含有0.125mol铁元素,
若用足量的CO在高温下还原相同质量的此混合物,根据质量守恒可知,能得到铁的物质的量为0.125mol,质量为:56g/mol×0.125mol=7g,
故选A.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握质量守恒定律在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 煤经过气化和液化等物理变化可转化为清洁燃料 | |
| B. | 为了提高酒精的杀菌消毒效果,医院常用体积分数为100%的酒精 | |
| C. | 用浸泡过酸性高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的 | |
| D. | 石墨烯是一种从石墨材料中用“撕裂”方法“剥离”出的单层碳原子面材料,石墨烯和乙烯都属于烯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
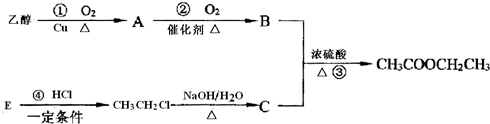
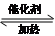 CH3COOCH2CH3+H2O;④CH2=CH2+HCl
CH3COOCH2CH3+H2O;④CH2=CH2+HCl CH3CH2Cl.
CH3CH2Cl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素、淀粉均属于高分子化合物 | |
| B. | 浓硝酸沾到皮肤上能使皮肤变黄,这是由于浓硝酸和蛋白质发生了颜色反应 | |
| C. | 糖类、油脂、蛋白质都只由C、H、O三种元素组成的 | |
| D. | 利用油脂在碱性条件下的水解,可以制得肥皂和甘油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2、I2、HI的浓度相等 | B. | H2、I2、HI的浓度之比为1:1:2 | ||
| C. | 混合气体的平均相对分子质量不变 | D. | 混合气体的颜色不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
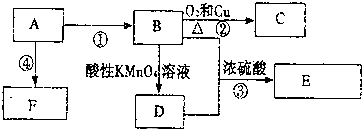
 ,F的结构简式
,F的结构简式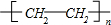 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molSO2(g)的能量总和大于lmol S(s)和l molO2(g)的能量总和 | |
| B. | 将2 molSO2(g)与l molO2(g)在一定条件下充分反应,放出196.6kJ的热量 | |
| C. | S(g)+O2(g)→SO2(g)+Q,Q值小于297.16 kJ | |
| D. | 当l mol S(s)完全转化为SO3(g)时(假设无热量损失),放出395.46kJ的热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com