
| A. | 漂白粉可用于养殖业消毒杀菌 | B. | SiO2可用于制光导纤维 | ||
| C. | FeCl3溶液可用于蚀刻铜制线路板 | D. | AlCl3可用于电解冶炼铝 |
分析 A.依据漂白粉具有氧化性,能够使蛋白质变性解答;
B.二氧化硅具有良好的光学特性;
C.三价铁离子具有强的氧化性,能够铜;
D.氯化铝为共价化合物,熔融状态不导电.
解答 解:A.漂白粉具有氧化性,能够使蛋白质变性,可用于养殖业消毒杀菌,故A正确;
B.二氧化硅具有良好的光学特性,可以用于制光导纤维,故B正确;
C.三价铁离子具有强的氧化性,与铜反应生成氯化亚铁、氯化铜,FeCl3溶液可用于蚀刻铜制线路板,故C正确;
D..氯化铝为共价化合物,熔融状态不导电,工业上用电解氧化铝制取铝,故D错误;
故选:D.
点评 本题涉及物质的性质以及应用知识,明确物质的性质是解题关键,注意知识的归纳和整理,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用向上排空气法收集Na2SO3与浓硫酸反应生成SO2 | |
| B. | 用50mL量筒准确量取25.00mL NaOH溶液 | |
| C. | 除去乙酸乙酯中溶解解的乙酸,加NaOH溶液充分振荡、分液 | |
| D. | 向含有CuCl2的FeC13溶液中加足量铁粉搅拌、过滤,得到纯净FeCl3溶液. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的还原性依次增强,热稳定性依次减弱 | |
| B. | 形成离子键的阴阳离子间只存在静电吸引力 | |
| C. | ⅠA金属元素是同周期中金属性最强的元素 | |
| D. | P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温、高压、催化剂条件下,足量N2与3 mol H2充分反应,共断裂H-H键3NA | |
| B. | 46 g Na与0.5 L 2 mol•L-1盐酸充分反应,转移电子数为2NA | |
| C. | 8.4 g固体NaHCO3中,含有阳离子0.2NA | |
| D. | 标准状况下,2.24 L CCl4含有的共价键数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
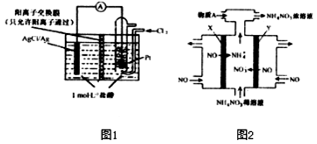 氧化还原反应与生产、生活、科技密切相关,请回答下列问题:
氧化还原反应与生产、生活、科技密切相关,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
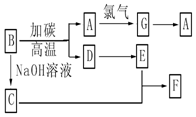 请回答下列问题:
请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com