
| 氢化物 | A | B | HF | D | E |
| 沸点/℃ | 1317 | 100 | 19.5 | -33.35 | -164 |
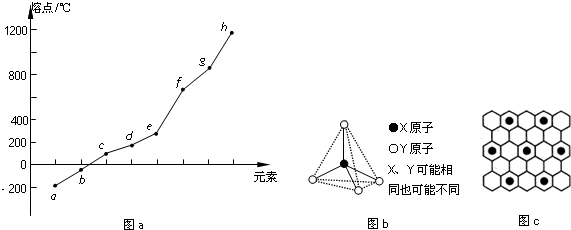
分析 (1)H2O分子间可以形成氢键,第VIA族元素形成的气态氢化物中水的沸点最高;
(2)LiH属于离子晶体,其它氢化物属于分子晶体,LiH的沸点最高,而氨气、水、HF分子均存在氢键,沸点均高于甲烷的;
第三周期中Si单质为原子晶体,其熔点最高;
(3)第二、第三周期的某些元素中能形成正四面体结构单元的单质甲和化合物乙,甲和乙的晶体类型相同,且二者在高温下发生反应,则甲为碳单质(金刚石)、乙为二氧化硅,h为Si,反应生成的Si的单质含有1mol共价键,每个Si原子形成4个Si-Si,每个Si-Si键为1个Si原子提供$\frac{1}{2}$,则生成Si为0.5mol,结合Si原子守恒计算二氧化硅的质量;
(4)碳元素的某种单质具有平面层状结构,该单质为石墨;
K原子镶嵌在正六边形的中心,该正六边形周围有6个未镶嵌K原子正六边形结构,即镶嵌K原子的正六边形周围连接6个C原子,该碳原子为3个正六边形共有,根据均摊法计算.
解答 解:(1)H2O分子间可以形成氢键,第VIA族元素形成的气态氢化物中水的沸点最高,水分子中O原子形成2个O-H键,含有2对孤对电子,空间结构为V形,
故答案为:H2O;H2O分子间可以形成氢键;V形;
(2)离子晶体的氢化物其沸点最大,所以A是离子晶体,第二周期中属于分子晶体的氢化物有甲烷、氨气、水和氟化氢,氨气、水和氟化氢中含有氢键,且水是液态,所以这四种氢化物中水的沸点最大,甲烷的沸点最低,故E为CH4,
第三周期中Si单质为原子晶体,其熔点最高,故h的元素符号为Si,
故答案为:CH4;Si;
(3)第二、第三周期的某些元素中能形成正四面体结构单元的单质甲和化合物乙,甲和乙的晶体类型相同,且二者在高温下发生反应,则甲为碳单质(金刚石)、乙为二氧化硅,h为Si,反应生成的Si的单质含有1mol共价键,每个Si原子形成4个Si-Si,每个Si-Si键为1个Si原子提供$\frac{1}{2}$,则生成Si为0.5mol,结合Si原子守恒,参加反应二氧化硅的质量为0.5mol×60g/mol=30g,
故答案为:30;
(5)碳元素的某种单质具有平面层状结构,该单质为石墨;
K原子镶嵌在正六边形的中心,该正六边形周围有6个未镶嵌K原子正六边形结构,即镶嵌K原子的正六边形周围连接6个C原子,该碳原子为3个正六边形共有,故结构中K原子与C原子数目之比为1:(6+6×$\frac{1}{3}$)=8,故化学式为KC8,
故答案为:石墨;KC8.
点评 本题是对物质结构与性质的考查,涉及晶体类型与熔沸点关系、元素化合物推断、晶胞计算等,(5)中的关键是寻找重复结构单元,可以用黑色球构成的正三角形解答更简单,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的熔沸点逐渐降低 | B. | 单质的氧化性逐渐增强 | ||
| C. | 相同条件下,单质的密度逐渐变小 | D. | 单质的颜色逐渐加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AgNO3溶液中加入几滴NaCl溶液生成白色沉淀,再向试管内加入KI溶液若生成黄色沉淀,则证明KSP(AgCl)>KSP(AgI) | |
| B. | Na2CO3溶液滴入硼酸溶液中,无气泡生成,说明Ka:H2CO3>H3BO3 | |
| C. | 等物质的量浓度、等体积的CH3COONa和NaClO阴离子的总数前者小于后者 | |
| D. | 若弱酸的酸性H2A>H2B>HA->HB-,则等物质的量浓度等体积的Na2A、Na2B溶液中,离子数目前者大于后者 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com