
【题目】元素周期表中的四种元素![]() 的有关信息如下,请用合理的化学用语填写空白。
的有关信息如下,请用合理的化学用语填写空白。
在周期表中的区域 | 元素代号 | 有关信息 |
短周期元素 |
|
|
|
| |
长周期元素 |
|
|
|
|
(1)![]() 元素周期表中的位置为___________,
元素周期表中的位置为___________,![]() 、
、![]() 、
、![]() 三种元素的简单离子半径从大到小的顺序为__________。
三种元素的简单离子半径从大到小的顺序为__________。
(2)足量![]() 的最高价氧化物的水化物的稀溶液与
的最高价氧化物的水化物的稀溶液与![]() 甲完全反应,放出热量
甲完全反应,放出热量![]() ,请写出表示该过程中和热的热化学方程式____________。
,请写出表示该过程中和热的热化学方程式____________。
(3)下列有关![]() 的气态氢化物丁的说法正确的有_____________(选填字母)
的气态氢化物丁的说法正确的有_____________(选填字母)
a、丁比氯化氢沸点高 b、丁比氯化氢稳定性好
c、丁比氟化氢还原性强 d、丁比氟化氢酸性弱
(4)请写出丙溶于丁的水溶液的离子方程式____________;乙的水溶液呈酸性,请写出离子方程式解释原因_____________。
(5)![]() 是一种弱酸,请写出它的电离方程式__________________;
是一种弱酸,请写出它的电离方程式__________________;![]() 溶液有剧毒,可以用
溶液有剧毒,可以用![]() 溶液进行无毒化处理,请写出二者反应的化学方程式__________________;室温下,
溶液进行无毒化处理,请写出二者反应的化学方程式__________________;室温下,![]() 的电离常数
的电离常数![]() ,在
,在![]() 的
的![]() 溶液中滴加同浓度盐酸至溶液呈中性,此时溶液中的
溶液中滴加同浓度盐酸至溶液呈中性,此时溶液中的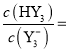 _____________。
_____________。
【答案】第三周期Ⅲ![]() 族
族 ![]()
![]()
![]() ac
ac ![]()
![]()
![]()
![]()
![]()
【解析】
![]() 的最高价氧化物的水化物甲是一种胃酸中和剂,且能溶于强碱溶液,则甲为氢氧化铝,X为Al元素;
的最高价氧化物的水化物甲是一种胃酸中和剂,且能溶于强碱溶液,则甲为氢氧化铝,X为Al元素;![]() 的一种氢化物可用于制造纯碱和做制冷剂,则该氢化物为氨气,Y为N元素;
的一种氢化物可用于制造纯碱和做制冷剂,则该氢化物为氨气,Y为N元素;![]() 的一种盐乙可以做净水剂,
的一种盐乙可以做净水剂,![]() 的某种氧化物丙可以做红色涂料,则丙为氧化铁,乙为铁盐,Z为Fe元素;
的某种氧化物丙可以做红色涂料,则丙为氧化铁,乙为铁盐,Z为Fe元素;![]() 元素大量存在于海藻中,它的银盐可用于人工降雨,则W为I元素,再结合元素周期律与物质的性质分析作答。
元素大量存在于海藻中,它的银盐可用于人工降雨,则W为I元素,再结合元素周期律与物质的性质分析作答。
根据上述分析可知,X、Y、Z和W分别为Al、N、Fe和I元素,则:
(1)![]() 元素为Al,原子序数为13,在周期表中的位置为第三周期Ⅲ
元素为Al,原子序数为13,在周期表中的位置为第三周期Ⅲ![]() 族;原子的电子层数越大,其原子半径越大,电子层数相同时,其离子半径随着原子序数增大而减小,则
族;原子的电子层数越大,其原子半径越大,电子层数相同时,其离子半径随着原子序数增大而减小,则![]() 、
、![]() 、
、![]() 三种元素的简单离子半径从大到小的顺序为
三种元素的简单离子半径从大到小的顺序为![]() ,
,
故答案为:第三周期Ⅲ![]() 族;
族;![]()
(2)![]() 的最高价氧化物的水化物为
的最高价氧化物的水化物为![]() 完全反应,放出热量
完全反应,放出热量![]() ,则反应生成1mol水所放出的热量为
,则反应生成1mol水所放出的热量为![]() ,则表示该过程中和热的热化学方程式为
,则表示该过程中和热的热化学方程式为![]()
![]() ,
,
故答案为:![]()
![]() ;
;
(3)![]() 的气态氢化物丁为HI,则:
的气态氢化物丁为HI,则:
a. HCl与HI均为分子化合物,其分子间作用力越大,沸点越高,则分子间作用力比较:HI>HCl,则沸点比较:HI>HCl,a项正确;
b. 非金属性越强,对应气态氢化物的稳定性越高,则碘化氢比氯化氢稳定性低,b项错误;
c. 同族元素中非金属性从上到下依次减弱,单质的氧化性依次减弱,相应离子的还原性依次增强,则碘化氢比氟化氢还原性强,c项正确;
d. 氟化氢为弱酸,碘化氢为强酸,则碘化氢比氟化氢酸性强,d项错误;
答案选ac;
(4)丙为氧化铁,丁为HI,两者会发生氧化还原反应,其离子方程式为:![]() ,乙为铁盐,在溶液中会水解显酸性,其离子方程式为:
,乙为铁盐,在溶液中会水解显酸性,其离子方程式为:![]() ,
,
故答案为:![]() ;
;![]() ;
;
(5)HY3为HN3,是一种弱酸,则在水溶液中发生弱电离,其离子方程式为:![]() ;NaClO与NaN3发生氧化还原反应,其离子方程式为:
;NaClO与NaN3发生氧化还原反应,其离子方程式为:![]() ;
;![]() 的电离常数
的电离常数![]() ,则根据表达式
,则根据表达式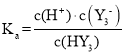 可知,
可知, =5×10-3=0.005,
=5×10-3=0.005,
故答案为:![]() ;
;![]() ;
;![]() 。
。


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 常温下,1L 0.1mol·L-1醋酸钠溶液中加入醋酸至溶液为中性,则溶液含醋酸根离子数0.1NA
B. 6g SiO2晶体中含有Si-O键的数目为0.2NA
C. 1mol乙酸与足量的乙醇发生酯化反应,生成乙酸乙酯分子数为NA
D. 某温度下, pH=2的H2SO4溶液中,硫酸和水电离的H+总数为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于4NH3(g) + 3O2(g) = 2N2(g) + 6 H2O(g) 的反应来说,以下化学反应速率的表示中反应速率最快的是
A. v(NH3)=0.6 mol L-1min-1B. v(O2) =0.4 mol L-1min-1
C. v(N2)=0.2 mol L-1min-1D. v(H2O) =0.3 mol L-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. ![]() 在
在![]() 中燃烧可以生成
中燃烧可以生成![]() 和
和![]() 的混合物
的混合物
B. 在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀
C. 相同温度下,![]() 在同浓度的
在同浓度的![]() 和
和![]() 溶液中的溶解度不相同
溶液中的溶解度不相同
D. 电解精炼铜时,同一时间内阴极析出铜的质量比阳极溶解铜的质量小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列化学方程式,并标明反应类型.
(1)CH4+Cl2![]() _____,_____;(只写产物均为气体的一个)
_____,_____;(只写产物均为气体的一个)
(2)CH2=CH2+Br2→__________,____________;
(3)![]() +Br2
+Br2![]() _________,_____。
_________,_____。
(4)与乙烯和氢气的加成产物互为同系物的是_____(填写编号)。
a C2H2 b C6H6 c C5H12 d C2H6O
(5)请写出乙烯加聚反应方程式_________
查看答案和解析>>
科目:高中化学 来源: 题型:
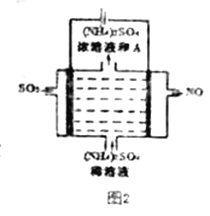
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、CO、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:
已知:H2的燃烧热为285.8kJ/mol
N2(g)+2O2(g)=2NO2(g)△H=+133kJ/mol
H2O(g)=H2O(l)△H=-44kJ/mol
(1)催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为__________________________。
Ⅱ.脱碳:
(2)向2L密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l)。
CH3OH(l)+H2O(l)。
下列叙述能说明此反应达到平衡状态的是__________。
A.混合气体的平均式量保持不变
B.CO2和H2的体积分数保持不变;
C.CO2和H2的转化率相等
D.混合气体的密度保持不变
E.1molCO2生成的同时有3molH—H键断裂
(3)在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,发生反应CO(g)+2H2(g)![]() CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图1所示。
CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图1所示。
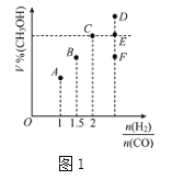
①当起始n(H2)/n(CO)=2,经过5min达到平衡,CO的转化率为0.4,则0~5min内平均反应速率V(H2)=__________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将__________(选填“增大”、“减小”或“不变”);
②当起始n(H2)/n(CO)=3.5时,达到平衡状态后,CH3OH的体积分数可能是图1中的___________点(选填“D”、“E”或“F”)
Ⅲ.脱硫:
如图2所示。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1![]() 氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法正确的是
氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法正确的是
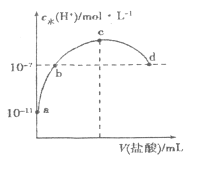
A. 常温下,0.1![]() 氨水中
氨水中![]() 的电离常数K约为
的电离常数K约为![]()
B. a、b之间的点一定满足,![]()
C. c点溶液中![]()
D. d点代表两溶液恰好完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g)。根据题意完成下列问题:
CH3OH(g)。根据题意完成下列问题:
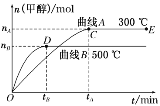
(1)反应达到平衡时,平衡常数表达式K=__________,升高温度,K值________(填“增大”“减小”或“不变”),平衡向__________方向移动。
(2)在500 ℃,从反应开始到平衡,氢气的平均反应速率v(H2)____________________。(用含相应字母的式子表示)
(3)在其他条件不变的情况下,将处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是________(填选项字母)。
A.氢气的浓度减小 B.正反应速率加快,逆反应速率也加快
C.甲醇的物质的量增加 D.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是________(用化学方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com