
| A. | NH4+、Na+、Br-、SO42- | |
| B. | Al3+、Cl-、OH-、HCO3- | |
| C. | pH=0的溶液中:ClO-、SO42-、Fe2+、K+ | |
| D. | 由水电离的c(OH-)=10-14mol•L-1的溶液中:CH3COO-、SO42-、Na+、NH4+ |
分析 A.四种离子之间不反应,能够共存;
B.铝离子与氢氧根离子、碳酸氢根反应,碳酸氢根离子与氢氧根离子反应;
C.pH=0的溶液为酸性溶液,次氯酸根离子与氢离子、亚铁离子反应;
D.由水电离的c(OH-)=10-14mol•L-1的溶液为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子,醋酸根离子与氢离子反应,铵根离子与氢氧根离子反应.
解答 解:A.NH4+、Na+、Br-、SO42-之间不反应,在溶液中能够大量共存,故A正确;
B.Al3+与OH-、HCO3-之间发生反应,OH-、HCO3-之间反应生成碳酸根离子和水,在溶液中不能大量共存,故B错误;
C.pH=0的溶液中存在大量氢离子,ClO-、Fe2+之间发生氧化还原反应,ClO-与氢离子反应,在溶液中不能大量共存,故C错误;
D.由水电离的c(OH-)=10-14mol•L-1的溶液中存在大量氢离子或氢氧根离子,CH3COO-与氢离子反应,NH4+与氢氧根离子反应,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


科目:高中化学 来源: 题型:解答题
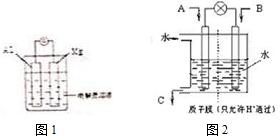 电能与化学能之间的转化具有重要的使用价值.
电能与化学能之间的转化具有重要的使用价值.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| B. | “地沟油”禁止食用,但可以用来制肥皂 | |
| C. | 合成纤维、人造纤维及碳纤维都属于有机高分子材料 | |
| D. | 用聚氯乙烯代替聚乙烯作食品包装袋,有利于节约成本 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1:n (HCl)=1 mol,K2CO3逐步加入到HCl溶液中,在敞口容器中生成的气体 | |
| B. | 图2:n (NaOH)=1 mol,CO2逐步通入到NaOH溶液中反应生成的盐 | |
| C. | 图3:n (O2)=1 mol,高温下C和O2在密闭容器中的反应产物 | |
| D. | 图4:n (HNO3)=1 mol,Fe和稀HNO3反应生成的氧化产物(还原产物为NO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
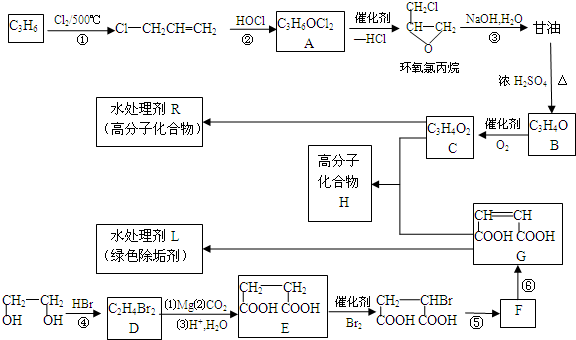
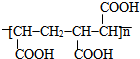 .
.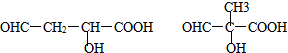
 的合成路线(无机原料任选).
的合成路线(无机原料任选).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
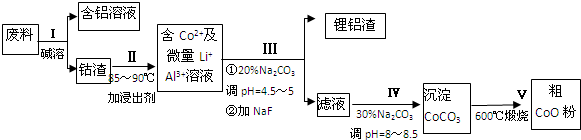
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
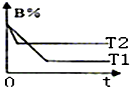 密闭容器中发生反应:A(g)+B(g)?C(g)△H.图中的两条曲线分别表示T1、T2温度下,体系中B的百分含量和时间t的关系.下列判断正确的是( )
密闭容器中发生反应:A(g)+B(g)?C(g)△H.图中的两条曲线分别表示T1、T2温度下,体系中B的百分含量和时间t的关系.下列判断正确的是( )| A. | △H<0,T1<T2 | B. | △H>0,T1<T2 | C. | △H<0,T1>T2 | D. | △H>0,T1>T2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 4 | ⑧ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| B. | 0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl) | |
| D. | 在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com