
2- 3 |
- 3 |
2- 3 |
- 3 |
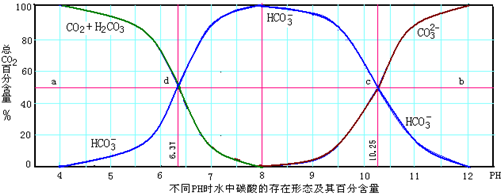
- 3 |
- 3 |
- 3 |
2- 3 |
2- 3 |


科目:高中化学 来源: 题型:
| A、大力开发和利用生物质能,促进可再生能源的发展 |
| B、利用核能、水库、潮汐等发电,可以减少火力发电对煤等化石燃料的使用 |
| C、H2是理想的绿色能源,可用电解水的方法进行获得 |
| D、推广利用太阳能、风能的照明系统,有利于实现城市的“蓝天工程” |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲、乙、丙、丁四种物质之间存在如图所示转化关系,且甲、乙、丙均含有相同的某种元素.下列推断错误的是( )
甲、乙、丙、丁四种物质之间存在如图所示转化关系,且甲、乙、丙均含有相同的某种元素.下列推断错误的是( )| A、若甲为焦炭,则丁可能是O2 |
| B、若甲为N2,则丙可能是NO2 |
| C、若甲为Cl2,则丁可能是Fe |
| D、若甲为NaOH溶液,则丁可能是CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| SaSO4 | BaSO4 | Sr(OH)2 | |
| Ksp | 3.3×10-7 | 1.1×10-10 | 3.2×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 回答下面关于有机实验的问题.
回答下面关于有机实验的问题.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)25℃时,部分弱酸的电离平衡常数如下表:
(1)25℃时,部分弱酸的电离平衡常数如下表:| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 | Ki=1.7×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1000:1 | B、100:1 |
| C、50:1 | D、10:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com