
【题目】根据所学,回答下列问题:
(1)①向苯酚钠溶液中通入少量CO2
②甲醛与新制的Cu(OH)2反应
③某有机物的结构简式如图所示,1mol该有机物与足量NaOH溶液共热,充分反应后最多可消耗NaOH的物质的量为mol 
(2)官能团对有机物性质起决定作用,但也会受到所连基团的影响.
①比较沸点 ![]()
![]() (填“>”“<”或“=”,下同)
(填“>”“<”或“=”,下同)
②比较水溶性: ![]()
![]()
③比较酸性:CH3COOH.
【答案】
(1)C6H5ONa+CO2+H2O→C6H6OH+NaHCO3;HCHO+4Cu(OH)2 ![]() 2Cu2O↓+5H2O+CO2↑;8
2Cu2O↓+5H2O+CO2↑;8
(2)<;<;>
【解析】解:(1)①苯酚钠和二氧化碳、水反应生成苯酚和碳酸氢钠,反应方程式为C6H5ONa+CO2+H2O→C6H6OH+NaHCO3 , 所以答案是:C6H5ONa+CO2+H2O→C6H6OH+NaHCO3;
②甲醛和新制氢氧化铜悬浊液发生氧化反应生成二氧化碳、水和 氧化亚铜,反应方程式为HCHO+4Cu(OH)2 ![]() 2Cu2O↓+5H2O+CO2↑,
2Cu2O↓+5H2O+CO2↑,
所以答案是:HCHO+4Cu(OH)2 ![]() 2Cu2O↓+5H2O+CO2↑;
2Cu2O↓+5H2O+CO2↑;
③由结构简式可知,分子中含﹣COOH、﹣Cl、﹣Br、﹣COOC﹣均与NaOH溶液反应,且与苯环直接相连的﹣Cl、﹣Br水解生成的酚﹣OH、﹣COOC﹣水解生成的酚﹣OH也与NaOH反应,则1mol该有机物与足量的NaOH溶液共热,充分反应后最多可消耗NaOH的物质的量为8mol,所以答案是:8;
(2.)①碳原子个数相同的醇中醇羟基个数越多,其熔沸点越高,所以熔沸点前者小于后者,所以答案是:<;
②醛与水以任意比混溶,烷烃难溶于水,甲基降低醛基的溶解度,所以水溶性: ![]() <
< ![]() ,所以答案是:<;
,所以答案是:<;
③苯甲酸中羧基上的氢离子电离后形成的负离子和苯环的共轭结构发生共轭,使苯甲酸根离子比乙酸根离子更稳定,所以酸性苯甲酸强,所以答案是:>.
【考点精析】解答此题的关键在于理解有机物的结构和性质的相关知识,掌握有机物的性质特点:难溶于水,易溶于汽油、酒精、苯等有机溶剂;多为非电解质,不易导电;多数熔沸点较低;多数易燃烧,易分解.


科目:高中化学 来源: 题型:
【题目】口香糖中常用木糖醇做甜味剂,木糖醇可以防止龋齿,木糖醇的结构简式为: ![]() ,下列有关木糖醇的说法正确的是( )
,下列有关木糖醇的说法正确的是( )
A.木糖醇是﹣种单糖,不能发生水解反应
B.木糖醇易溶解于水,不能发生酯化反应
C.木糖醇在口腔中不易被氧化为酸
D.木糖醇脱去三分子水可得糠醛(结构如图)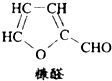
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年美国介入放射学科研大会上展示了保罗放射学研究所治疗严重冻伤的医疗成果,可免除冻伤病人截肢.以下关于具有放射性的 ![]() I的说法正确的是( )
I的说法正确的是( )
A.它的中子数是53
B.摩尔质量是125g
C.它与 ![]() I 互称同位素
I 互称同位素
D.其化学性质与 ![]() I有很大区别
I有很大区别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数,下列说法正确的是( )
A.2.4g金属镁变成镁离子时失去的电子数目为0.1NA
B.标准状况下,2.24LBr2所含的分子数为0.1NA
C.室温下,32gO2和O3的混合气体中含有的氧原子数为2NA
D.1.0molL﹣1的Na2CO3溶液中含有的Na+离子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用锌粒和稀硫酸制取H2,下列措施可使反应速率加快的是( )
A. 改用98%的浓硫酸B. 增加锌粒的量C. 用锌块代替锌粒D. 加入少许硫酸铜溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).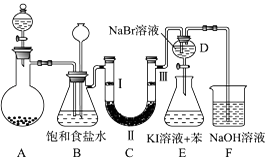
(1)装置A中两个玻璃仪器名称分别是和 .
(2)如何检查A装置的气密性? .
(3)实验时多余的氯气可用F装置来吸收,有关化学方程式是 .
(4)装置B中饱和食盐水的作用是 .
(5)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入湿润有色布条;;(可供选择的用品有:无水氯化钙、碱石灰、浓硫酸)和干燥的有色布条.
(6)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为橙色,说明氯气的氧化性溴单质(填“大于”或“小于”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中产生的SO2、NO直接排放将对大气造成严重污染,利用电化学原理吸收SO2和NO,同时获得Na2S2O4和NH4NO3产品的工艺流程图如下(Ce为铈元素). 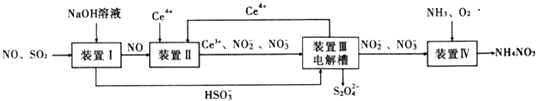
请回答下列问题.
(1)装置Ⅱ中NO在酸性条件下生成NO2﹣的离子方程式 .
(2)含硫各微粒(H2SO3、HSO3﹣和SO32﹣)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示. 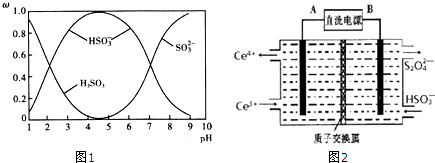
①下列说法正确的是(填标号).
A.pH=7时,溶液中c(Na+)<c(HSO3﹣)+c(SO32﹣)
B.由图中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10﹣7
C.为获得尽可能纯的NaHSO3 , 应将溶液的pH控制在4~5为宜
D.pH=9时的溶液中c(OH﹣)=c(H+)+c(HSO4﹣)+c(H2SO4)
②若1L1mol/L的NaOH溶液完全吸收13.44L(标况下)SO2 , 则反应的离子方程式为 .
③取装置Ⅰ中的吸收液vmL,用cmol/L的酸性高锰酸钾溶液滴定.酸性高锰酸钾溶液应装在(填“酸式”或“碱式”)滴定管中,判断滴定终点的方法是 .
(3)装置Ⅲ的作用之一是再生Ce4+ , 其原理如图2所示. 图中A为电源的(填“正”或“负”)极.右侧反应室中发生的主要电极反应式为 .
(4)已知进人装置Ⅳ的溶液中NO2﹣的浓度为0.4mol/L,要使1m3该溶液中的NO2﹣完全转化为NH4NO3 , 需至少向装置Ⅳ中通入标准状况下的O2的体积为L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如果Fe3+、SO42-、Al3+和M四种离子以物质的量之比为2∶4∶1∶1共同存在于同一种溶液中,那么M可能是( )
A. Na+B. OH-C. CO32-D. Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com