
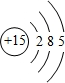 ;
;分析 (1)磷是15号元素原子结构示意图中有三个电子层,最外层5个电子;
(2)H3PO2是一元弱酸,则NaH2PO2为正盐,酸根离子在水溶液里水解导致溶液呈碱性;
(3)根据转移电子守恒判断氧化产物,该反应中银离子是氧化剂、H3PO2是还原剂,氧化剂与还原剂的物质的量之比为4:1,根据转移电子相等知,1molH3PO2失去4mol电子,所以P元素为+5价.
解答 解:(1)磷是15号元素原子结构示意图中有三个电子层,最外层5个电子,原子结构示意图为: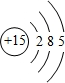 ,故答案为:
,故答案为: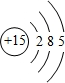 ;
;
(2)H3PO2是一元弱酸,则NaH2PO2为正盐,酸根离子在水溶液里水解导致溶液呈碱性,溶液中离子浓度大小为:c(Na+)>c(H2PO2-)>c(OH-)>c(H+),
故答案为:正盐; c(Na+)>c(H2PO2-)>c(OH-)>c(H+);
(3)根据化合物中化合价的代数和为0,确定H3PO2中P元素化合价,O元素为-2价、H元素为+1价,所以P元素为+1价,该反应中银离子是氧化剂、H3PO2是还原剂,氧化剂与还原剂的物质的量之比为4:1,根据转移电子相等知,1molH3PO2失去4mol电子,所以P元素为+5价,则氧化产物是H3PO4,
故答案为:H3PO4.
点评 本题考查氧化还原反应、电离方程式的书写、盐类水解等知识点,明确物质的性质是解本题关键,利用电离方程式书写规则、盐类水解原理解答即可,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 .
.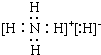 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是对应的单质分子,而钙、铁则指的是对应的钙离子和铁离子 | |
| B. | 淀粉及做衣服的棉和麻均为天然高分子化合物 | |
| C. | 煎炸食物的花生油和牛油都是可水解的饱和酯类 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
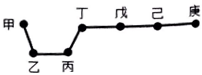 短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )
短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )| A. | 甲一定是金属元素 | |
| B. | 气态氢化物的稳定性:庚>己>戊 | |
| C. | 乙、丙、丁的最高价氧化物水化物可以以相互反应 | |
| D. | 庚的最高价氧化物水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
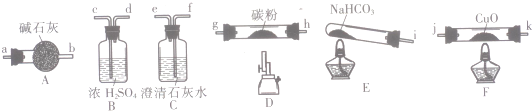
| 实验编号 | 操作 | 现象 |
| a | 加入足量稀硝酸、振荡 | 试管内红色固体完全溶解,溶液变为蓝色,并有无色气体产生 |
| b | 加入足量稀硫酸、振荡 | 试管内有红色固体,溶液为无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
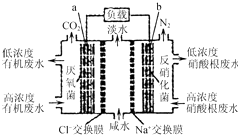 一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物可用C6H10O5表示.下列有关说法正确的是( )
一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物可用C6H10O5表示.下列有关说法正确的是( )| A. | b电极为该电池的负极 | |
| B. | b电极附近溶液的pH减小 | |
| C. | a电极反应式:C6H10O5-24e-+7H2O═6CO2↑+24H+ | |
| D. | 中间室:Na+移向左室,Cl-移向右室 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2014年11月10日APCE国宴采用的帝王彩瓷餐具和常见的水晶饰品都属于硅酸盐制品 | |
| B. | 20mL0.1mol•L-1NaOH分别与10mL 0.2mol•L-1 CH3COOH、20mL0.1mol•L-1 CH3COOH反应,前者放出的热量比后者少 | |
| C. | Na2SO4•10H2O$?_{冷却}^{受热}$Na2SO4+10H2O利用该反应可以实现太阳能和化学能的相互转换 | |
| D. | 浓硫酸具有不同于稀硫酸的强氧化性、吸水性和脱水性等,主要是由于稀硫酸和浓硫酸中存在的主要微粒不同引起的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 4种 | C. | 3种 | D. | 2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
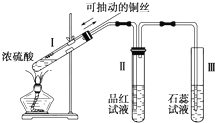 某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验.请回答:
某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com