
分析 已知:①CH≡CH(g)+H2(g)→CH2=CH2(g)△H=-174kJ•mol-1
②CH≡CH(g)+2H2 (g)→C2H6(g)△H=-311kJ•mol-1,
根据盖斯定律:②-①得到CH2=CH2(g)+H2(g)→C2H6(g),据此计算.
解答 解:已知:①CH≡CH(g)+H2(g)→CH2=CH2(g)△H=-174kJ•mol-1
②CH≡CH(g)+2H2 (g)→C2H6(g)△H=-311kJ•mol-1,
由盖斯定律:②-①得到CH2=CH2(g)+H2(g)→C2H6(g),△H=(-311kJ•mol-1)-(-174kJ•mol-1)=-137kJ/mol;
故答案为:-137kJ/mol.
点评 本题考查了反应热的计算,题目难度不大,侧重于考查盖斯定律的应用和计算,题目有利于培养学生的分析能力和计算能力.


科目:高中化学 来源: 题型:选择题
| M | N | ||
| X | Y |
| A. | 元素的第一电离能X<Y | |
| B. | X位于第三周期 IIA,其单质可采用电解熔融其氯代物制备 | |
| C. | 元素最高价氧化物的水化物中,酸性最强的是HNO3 | |
| D. | 气体分子(MN)2的电子式为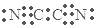 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
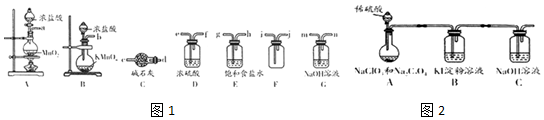
 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应的进行程度越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应的进行程度越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
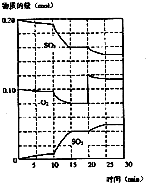
| A. | 达到平衡所需的时间为:甲>乙 | B. | 甲的转化率>乙的转化率 | ||
| C. | 混合气体中SO3的含量为:甲>乙 | D. | 气体的总物质的量:甲<乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.15 mol•L-1 | B. | 0.10 mol•L-1 | C. | 0.25 mol•L-1 | D. | 0.40 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com