
【题目】如表所示为元素周期表的一部分,参照元素①~⑩在表中的位置,请回答下列问题: 
(1)写出①和④两种元素原子按1:1组成的常见化合物的电子式
(2)用电子式表示⑥和⑨形成化合物的过程:
(3)③、⑧、⑩的最高价氧化物对应水化物的酸性由强到弱的顺序为(用化学式表示).
(4)已知周期表中存在对角相似规则,如②与⑦在周期表中处于对角线位置则化学性质相似,②的氧化物、氢氧化物也有两性,写出②的氢氧化物与⑥的氢氧化物反应的化学方程式 .
(5)⑤、⑥、⑩的离子半径由大到小的顺序为(用离子符号表示).
【答案】
(1)![]()
(2)![]()
(3)HClO4>HNO3>H3PO4
(4)Be(OH)2+2NaOH=Na2BeO2+2H2O
(5)Cl﹣>F﹣>Na+
【解析】解:由元素在周期表中位置,可知①是H,②是Be,③是N,④是O,⑤是F,⑥是Na,⑦是Al,⑧是P,⑨是S,⑩是Cl.
(1.)①和④两种元素原子按1:1组成的常见化合物为过氧化氢,其电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;
;
(2.)⑥和⑨形成化合物为硫化钠,为离子化合物,用电子式表示⑥和⑨形成化合物的过程为 ![]() ,
,
所以答案是: ![]() ;
;
(3.)非金属性越强,对应最高价氧化物对应水化物的酸性越强,③、⑧、⑩的最高价氧化物对应水化物的酸性由强到弱的顺序为HClO4>HNO3>H3PO4 , 所以答案是:HClO4>HNO3>H3PO4;
(4.)②的氢氧化物与⑥的氢氧化物反应,生成偏铍酸钠、水,反应方程式为Be(OH)2+2NaOH=Na2BeO2+2H2O,所以答案是:Be(OH)2+2NaOH=Na2BeO2+2H2O;
(5.)电子层越多,离子半径越大;具有相同电子排布的离子,原子序数大的离子半径小,)⑤、⑥、⑩的离子半径由大到小的顺序为Cl﹣>F﹣>Na+ , 所以答案是:Cl﹣>F﹣>Na+ .


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】I.实验室用50 mL 0.50mol/L盐酸、50mL 0.55 mol/LNaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:

实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
完成下列问题:
(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是____。
(2)在操作正确的前提下,提高中和热制定准确性的关键是____.
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H=____[盐酸和NaOH溶液的密度按1g/cm3计算,反应后混合溶液的比热容(c)按4.18J/(g.℃)计算].
(4)如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将_____(填“偏大”、“偏小”、“不变”).如改用60 mL0.5moI/L的盐酸与50 mL 0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等”或“不相等”),所求中和热_____(填“相等”或“不相等”)。
(5)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是______________。
A.测量盐酸的温度后,温度计没有用水冲洗干净
B. 把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F大烧杯的盖扳中间小孔太大。
Ⅱ.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过褪色所需时间来判断反应的快慢。该小组设计了如下方案:

(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4) ≥_______。
(2)试验编号②和③探究的内容是_____________。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时同内平均反应速率v(KMnO4)=__________mol·L-1·min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《天工开物》中记载丝织品的处理:“凡帛织就犹是生丝,煮练方熟。练用稻稿灰入水煮。以猪胰脂陈宿一晚,入汤浣之,宝色烨然。”下列有关说法不正确的是
A. 生丝的主要成分为蛋白质
B. 稻稿灰含有碳酸钾,其入水后溶液呈碱性
C. 该过程实际就是生丝的除杂过程
D. 生丝煮练之后变为熟丝,熟丝的成分是氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活、社会可持续发展密切相关。下列说法正确的是
A.蛋白质在人体内水解为氨基酸和甘油等小分子物质后才能被吸收
B.丝绸的主要成分是天然纤维素,属于高分子化合物
C.高铁车用大部分材料是铝合金,铝合金材料具有质量轻、抗腐蚀能力强等优点
D.中秋节吃月饼,为防止月饼富脂易变质,常在包装袋中加入生石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列叙述,推测可能属于金属晶体的是( )
A.由分子间作用力结合而成,熔点很低
B.固体或熔融状态下易导电,熔点在1000℃左右
C.由共价键结合成空间网状结构,熔点很高
D.固体不导电,熔融状态下亦不导电,但溶于水后能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是( )
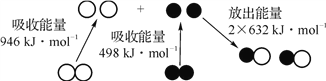
A. 放电条件下,N2(g)和O2(g)混合能直接化合生成NO(g)
B. NO是一种酸性氧化物,能用NaOH溶液处理含NO的尾气
C. N2(g)和O2(g)反应生成 NO(g),相当于N2(g)在O2(g)燃烧,该反应放热
D. 28 g N2(g)和32 g O2(g)完全反应生成 NO(g),放出的能量为180 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡.则原混合溶液中钾离子的浓度为( )
A.![]() mol?L﹣1
mol?L﹣1
B.![]() mol?L﹣1
mol?L﹣1
C.![]() mol?L﹣1
mol?L﹣1
D.![]() mol?L﹣1
mol?L﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com