
下列说法正确的是( )
|
| A. | 电解质在溶液中存在电离平衡状态 |
|
| B. | 电离平衡状态时v结合=v电离=0 |
|
| C. | 弱电解质溶液中,既存在离子也存在分子 |
|
| D. | 电解质的电离是可逆过程 |
考点:
弱电解质在水溶液中的电离平衡.
专题:
电离平衡与溶液的pH专题.
分析:
A.弱电解质在水溶液中存在电离平衡;
B.电离平衡状态时,电解质电离和离子结合速率相等但不等于0;
C.弱电解质在水溶液里部分电离;
D.弱电解质的电离是可逆的.
解答:
解:A.弱电解质在水溶液中存在电离平衡,强电解质在水溶液里完全电离,故A错误;
B.电离平衡状态时,电解质电离和离子结合速率相等但不等于0,为动态平衡,故B错误;
C.弱电解质在水溶液里部分电离,所以溶液中存在离子和分子,故C正确;
D.弱电解质的电离是可逆的,强电解质的电离不可逆,故D错误;
故选C.
点评:
本题考查了弱电解质的电离,明确弱电解质电离特点及电离平衡状态的判断即可解答,注意:弱电解质电离平衡状态时为动态平衡,反应不停止,为易错点.


科目:高中化学 来源: 题型:
下列各项叙述中,正确的是( )
|
| A. | 电子层序数越大,s原子轨道的形状相同、半径越小 |
|
| B. | 在同一电子层上运动的电子,其自旋方向肯定不同 |
|
| C. | 镁原子由1s22s22p63s2→ls22s22p63p2时,原子吸收能量,由基态转化成激发态 |
|
| D. | 原子最外层电子排布是5s1的元素,其氢氧化物不能使氢氧化铝溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
判断溶液的酸碱性有多种方法.下列溶液中,一定呈碱性的是( )
|
| A. | 能够使甲基橙呈现黄色 | B. | 溶液的pH>7 |
|
| C. | 溶液中:c(H+)<c(OH﹣) | D. | 溶液中:c(H+)>1×10﹣7mol•L﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
反应2X(g)+Y(g)═2Z(g)+热量,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是( )
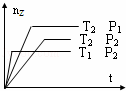
|
| A. | T1<T2,P1<P2 | B. | T1<T2,P1>P2 | C. | T1>T2,P1>P2 | D. | T1>T2,P1<P2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2 (g)⇌2SO3(g)(△H<0)
(1)写出该反应的化学平衡常数表达式K= .
(2)降低温度,该反应K值 ,二氧化硫转化率 ,化学反应速率 (以上均填增大、减小或不变).
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 .
(4)据图判断,反应进行至20min时,曲线发生变化的原因是 (用文字表达)
(5)10min到15min的曲线变化的原因可能是 (填写编号).
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量.
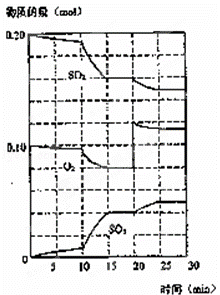
查看答案和解析>>
科目:高中化学 来源: 题型:
工业合成氨与制备硝酸一般可连续生产,流程如下:
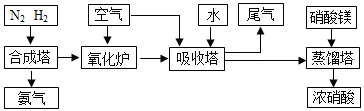
(1)简述原料气N2、H2的 。(2)下列可以代替硝酸镁加入到蒸馏塔中的是:
A.浓硫酸 B.氯化钙 C.氯化镁 D.生石灰
(3)氨气和氧气145℃就开始反应,在不同温度和催化剂时生成不同产物(如图所示):
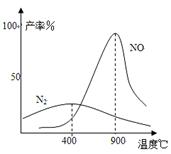
4NH3+5O2 4NO+6H2O K1=1×1053(900℃)
4NO+6H2O K1=1×1053(900℃)
4NH3+3O2 2N2+6H2O K2=1×1067(900℃)
2N2+6H2O K2=1×1067(900℃)
温度较低时以生成 为主,温度高于900℃时,
NO产率下降的原因 。
吸收塔中需要补充空气的原因 。
(4)尾气处理时小型化工厂常用尿素作为氮氧化物的吸收剂,此法运行费用低,吸收效果好,不产生二次污染,吸收后尾气中NO和NO2的去除率高达99.95%。其主要的反应为氮氧化物混合气与水反应生成亚硝酸,亚硝酸再与尿素[CO(NH2)2]反应生成CO2 和N2,请写出有关反应化学方程式:
, 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com