
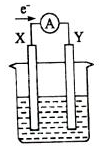
 如图所示的原电池装置,X、Y 为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图,对此装置的下列说法正确的是( )
如图所示的原电池装置,X、Y 为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图,对此装置的下列说法正确的是( )| A. | 外电路的电流方向为:X→外电路→Y | |
| B. | 若两电极分别为 Zn 和碳棒,则 X 为碳棒,Y 为 Zn | |
| C. | 若两电极都是金属,则它们的活动性为 X>Y | |
| D. | X 极上发生的是还原反应,Y 极上发生的是氧化反应 |
分析 原电池装置,X、Y为两个电极,电解质溶液为稀硫酸,由外电路中的电子流向可知,X为负极,Y为正极,结合负极发生氧化反应、负极金属活泼等来解答.
解答 解:由外电路中的电子流向可知,X为负极,Y为正极,
A.由图可知电子的流动方向是X→外电路→Y,则电流的方向应该为Y→外电路→X,故A错误;
B.X为原电池的负极,Y为正极,则X应为Zn,故B错误;
C.两个电极都是金属,X为负极,则X的活动性比Y强,故C正确;
D.X极上发生的是氧化反应,Y极上发生的是还原反应,故D错误;
故选C.
点评 本题考查原电池的工作原理,明确电子的流向判断正负极为解答的关键,侧重电子流向、电极判断及金属性比较、电极反应的考查,注重基础知识的训练,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | 分子式为C7H6O5 | B. | 分子中含有两种官能团 | ||
| C. | 1mol该有机物能与4molNaOH反应 | D. | 可发生加成和取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把金属铁放入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 将氢氧化铁放入盐酸中:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 氢氧化钡跟硫酸铜溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 石灰石跟盐酸反应:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
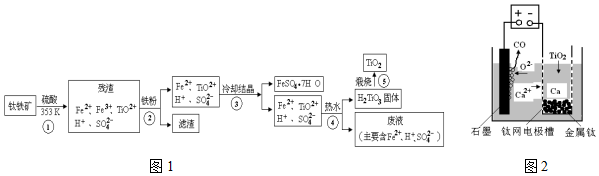
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
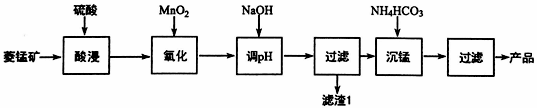
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA个H+的质量为1 g | |
| B. | 2 L 0.5 mol/L Na2SO4溶液中含NA个Na+ | |
| C. | 32 g O2中含有2NA个氧原子 | |
| D. | 标准状况下,1 mol H2O中含有NA个分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com