
【题目】下列物质在生活中应用时,起还原作用的是( )
A. 明矾作净水剂 B. 硅胶作干燥剂
C. 漂粉精作消毒剂 D. 铁粉作食品袋内的脱氧剂
科目:高中化学 来源: 题型:
【题目】(16分)下图中的实验装置可用于制取乙炔。请填空:
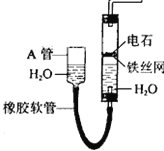
(1)图中,A管的作用是 。
制取乙炔的化学方程式是 。
(2)乙炔通入KMnO4酸性溶液中观察到的现象是 ,乙炔发生了 反应。
(3)乙炔通入溴的CCl4溶液中观察到的现象是 ,乙炔发生了 反应。
(4)为了安全,点燃乙炔前应 ,乙炔燃烧时的实验现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨与硝酸都是氮的重要化合物,在工农业生产中有广泛应用。回答下列问题:
(1)氨气的制备
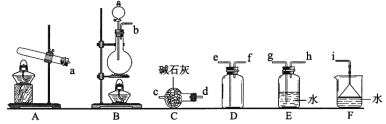
①氨气制取的发生装置可以选择上图中的_________(填字母),反应的化学方程式为_____________________________________________。
②选择上图装置组装一套实验装置来收集一瓶干燥的氨气,所选装置的连接顺序为:发生装置→______→______→______→_____→i(按气流方向,用小写英文字母表示)。
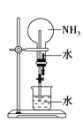
③可用如图装置进行氨的喷泉实验,引发喷泉的操作是_______________________________。
(2)如图所示,NH3经一系列反应可以得到HNO3。

①反应①的化学方程式为________________________________________。
②产物NO是大气污染物之一。在400℃左右且有催化剂存在的情况下,可用氨将一氧化氮还原为无色无毒气体。该反应的化学方程式为_______________________。
(3)在某100mL硝酸与硫酸的混合液中,HNO3和H2SO4的物质的量浓度分别为0.6 mol·L-1和0.3mol·L-1。向该混合液中加入3.84g铜粉,加热,待充分反应后,所得溶液中的Cu2+的物质的量浓度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】宝鸡被誉为“青铜器之乡”,出土了大盂鼎、毛公鼎、散氏盘等五万余件青铜器。研究青铜器(含Cu、Sn等)在潮湿环境中发生的腐蚀对于文物保护和修复有重要意义。下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图,下列说法不正确的是
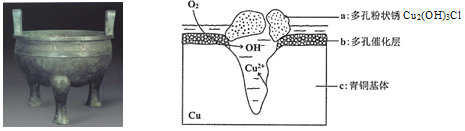
A. 青铜器发生电化学腐蚀,图中c作负极,被氧化
B. 正极发生的电极反应为O2+ 4e-+2H2O=4OH-
C. 环境中的Cl- 与正、负两极反应的产物作用生成a的离子方程式为2Cu2++3OH-+Cl-=Cu2 (OH)3Cl↓
D. 若生成0.2 mol Cu2(OH)3Cl,则理论上消耗的O2体积为4.48L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子不能大量共存于同一溶液中的是
A. NH4+、NO3-、Fe2+、H+ B. NO3-、Na+、Ba2+、Ag+
C. C1-、Cu2+、SO42-、NO3- D. SO42-、NO3-、K+、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚石和石墨是碳元素的两种结构不同的单质(同素异形体),在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的热能,据此,试判断在100kPa下,下列结论正确的是( )
A. 石墨比金刚石稳定
B. 金刚石比石墨稳定
C. 1mol石墨比1mol金刚石总能量高
D. 金刚石转化为石墨是物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 蚕丝、羊毛的主要成分都是蛋白质
B. 蔗糖、油脂及其水解产物均为非电解质
C. 油脂属于天然高分子化合物
D. 牛奶中加入NaCl溶液,会使蛋白质发生变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施不合理的是( )
A. 用SO2漂白纸浆和草帽辫 B. 用硫酸清洗锅炉中的水垢
C. NH3易液化,液氨常用作制冷剂 D. 用Na2S做沉淀剂,除去废水中的Cu2+和Hg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
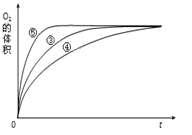
【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10mL2% H2O2溶液 | 无 |
② | 10mL5% H2O2溶液 | 无 |
③ | 10mL5% H2O2溶液 | 1mL0.1molL﹣1FeCl3溶液 |
④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1molL﹣1FeCl3溶液 |
⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1molL﹣1FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是___________________________________(用过渡态理论来解释);
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为_______________________;
(3)实验①和②的目的是_____________________________________________________;实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是____________________________________;
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。 分析图能够得出的实验结论是_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com