
【题目】硫酸亚铁是利用钛铁矿(主要成分FeTiO3)制金属钛的副产品,价格低。以硫酸亚铁为原料制备高效净水剂高铁酸钾(K2FeO4)可大大降低成本。其生产工艺如下:
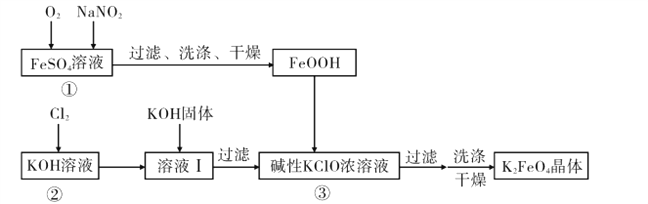
已知:NaNO2是在空气中将Fe2+氧化为铁黄(FeOOH)的催化剂;铁黄微溶于酸。
请问答下列问题:
(1)写出反应①生成铁黄(FeOOH)的离子方程式:__________________________________,
在通入O2“氧化”FeSO4的过程中,溶液的pH________(填“增大”“减小”或“不变”)
(2)“过滤、洗涤、干燥”制备铁黄时,检验铁黄表面已洗涤干净的操作是_____。
(3)写出反应③的化学方程式: ____。
(4)在溶液I中加KOH固体的目的是_____。
(5) K2FeO4可作为新型多功能水处理剂的原因是____。
(6)该工艺每消耗标准状况下ll2LCl2理论上得到____g K2FeO4。
(7)钛铁矿加入浓硫酸除生成TiOSO4外,还生成水和另外一种硫酸盐,且反应前后铁的化合价不变,化学方程式为____。
【答案】 4Fe2++O2 +6H2O ![]() 4FeOOH↓+8H+ 减小 取少量最后一次的洗涤液于试管中,滴加盐酸酸化的BaCl2溶液,若无白色沉淀生成,则说明已被洗净 2FeOOH +3KC1O+4KOH =2 K2FeO4+3H2O+3KCl 除KCl;为下一步反应提供反应物;除去过量Cl2 K2FeO4具有强氧化性,能杀菌消毒;消毒过程中白身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体能吸附水中悬浮杂质而沉降 660 FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
4FeOOH↓+8H+ 减小 取少量最后一次的洗涤液于试管中,滴加盐酸酸化的BaCl2溶液,若无白色沉淀生成,则说明已被洗净 2FeOOH +3KC1O+4KOH =2 K2FeO4+3H2O+3KCl 除KCl;为下一步反应提供反应物;除去过量Cl2 K2FeO4具有强氧化性,能杀菌消毒;消毒过程中白身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体能吸附水中悬浮杂质而沉降 660 FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
【解析】 (1)反应①中硫酸亚铁在亚硝酸钠存在时被氧气氧化生成铁黄(FeOOH)的离子方程式为4Fe2++O2 +6H2O ![]() 4FeOOH↓+8H+,根据方程式可知,在通入O2“氧化”FeSO4的过程中,溶液的酸性逐渐增强,pH减小,故答案为:4Fe2++O2 +6H2O
4FeOOH↓+8H+,根据方程式可知,在通入O2“氧化”FeSO4的过程中,溶液的酸性逐渐增强,pH减小,故答案为:4Fe2++O2 +6H2O ![]() 4FeOOH↓+8H+;减小;
4FeOOH↓+8H+;减小;
(2)铁黄表面附着少量硫酸钠溶液,检验铁黄表面已洗涤干净的操作为取少量最后一次的洗涤液于试管中,滴加盐酸酸化的BaCl2溶液,若无白色沉淀生成,则说明已被洗净,故答案为:取少量最后一次的洗涤液于试管中,滴加盐酸酸化的BaCl2溶液,若无白色沉淀生成,则说明已被洗净;
(3)根据流程图,反应③中铁黄与碱性次氯酸钾溶液反应生成K2FeO4,反应的化学方程式为,故答案为:2FeOOH +3KC1O+4KOH =2 K2FeO4+3H2O+3KCl;
(4)在溶液I中加KOH固体可以除去过量Cl2,也可以为下一步反应提供反应物,故答案为:除KCl;为下一步反应提供反应物;除去过量Cl2等;
(5) K2FeO4具有强氧化性,能杀菌消毒;消毒过程中白身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体能吸附水中悬浮杂质而沉降,使得K2FeO4成为新型多功能水处理剂,故答案为:K2FeO4具有强氧化性,能杀菌消毒;消毒过程中白身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体能吸附水中悬浮杂质而沉降;
(6) 标准状况下112LCl2的物质的量为5mol,氯气与氢氧化钾反应生成次氯酸钾,可以得到5molKClO,根据2FeOOH +3KC1O+4KOH =2 K2FeO4+3H2O+3KCl。可以得到5mol×![]() =
=![]() mol K2FeO4,质量为
mol K2FeO4,质量为![]() mol×198g/mol=660g,故答案为:660;
mol×198g/mol=660g,故答案为:660;
(7)钛铁矿(主要成分FeTiO3)加入浓硫酸除生成TiOSO4外,还生成水和另外一种硫酸盐,在TiOSO4中Ti的化合价为+4价,则FeTiO3中Fe的化合价为+2价,反应前后铁的化合价不变,则该硫酸盐为硫酸亚铁,反应的化学方程式为FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O,故答案为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】KCl样品中含有少量K2CO3、K2SO4和不溶于水的杂质,为了提纯KCl,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作:
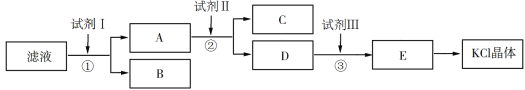
回答下列问题:
(1)为检验起始滤液中的Cl,所用试剂除了稀硝酸,还需要_____________溶液。
(2)试剂Ⅰ的化学式为________________,判断试剂Ⅰ已加过量的方法是_____________。
(3)试剂Ⅱ的化学式为__________________,②中加入试剂Ⅱ的目的是__________________。
(4)试剂Ⅲ的名称是__________,③中发生反应的离子方程式为________________。
(5)某同学根据最终所得KCl晶体的质量和原样品的质量计算出氯化钾样品的纯度,你认为结果可靠吗?并说明理由(不考虑实验误差):__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列性质的递变规律不正确的是
A.HCl、HBr、HI稳定性依次减弱
B.Na、Mg、Al的原子半径依次增大
C.NaOH、KOH、CsOH碱性依次增强
D.Li、Na、K、Rb、Cs单质的失电子能力逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2,则关于该反应体系说法错误的是
A.该反应的化学方程式为2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O
B.该反应中的氧化剂是H2O2,还原产物是O2
C.氧化性:H2CrO4>O2
D.如反应转移了0.3 rnol电子,则产生的气体在标准状况下体积为3.36 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的组成与结构决定了物质的性质与变化。请回答下列问题:
(1)C、H、N、O四种元素中电负性最大的是____(填元素符号),写出Fe2+的最外层电子排布式____。
(2)根据等电子原理,写出CN-的电子式___,CNO-中心原子的杂化方式为 ________。
(3)MgO、CaO两种晶体的结构与NaCl晶体结构相似,则两种离子晶体的熔点由高到低顺序是 ___(用化学式表示),![]() 的沸点比
的沸点比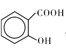 ____(填“高”或“低”);原因是______________________.
____(填“高”或“低”);原因是______________________.
(4)铁有δ、γ、α三种同素异形体,如下图所示。
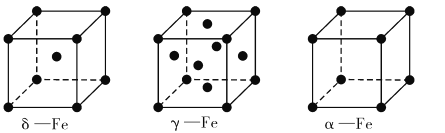
γ -Fe晶体的一个晶胞中所含有的铁原子数为____,δ一Fe、α- Fe两种晶胞中铁原子的配位数之比为____。已知δ-Fe晶体的密度为dg/cm3,NA表示阿伏伽德罗常数的数值,则Fe原子半径为____pm(列表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W的原子序数依次增大,四种元素形成的单质依次为m、n、p、q;r、t、u 是这些元素组成的二元化合物,其中u为葡萄酒中的抑菌成分;25 ℃,0.01 mol/L的v溶液中: 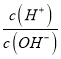 = 1.0×10-10。上述物质的转化关系如图所示,下列说法不正确的是
= 1.0×10-10。上述物质的转化关系如图所示,下列说法不正确的是
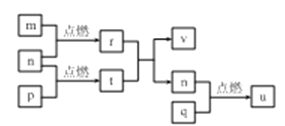
A. 简单离子半径:W>Y>Z>X
B. W,Y分別与X元素形成的简单化合物的沸点: Y> W
C. Z2Y和ZX都只存在离子键
D. v能抑制水的电离,u能促进水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】古代的很多谚语都蕴含着科学知识。下列对谚语的解释正确的是( )
A. “甘之如饴”说明糖类均有甜味
B. “玉不琢不成器”“百炼方能成钢”发生的都是化学变化
C. “火树银花”中的焰火实质上是金属元素的焰色反应
D. “冰,水为之,而寒于水”说明相同质量和温度的水和冰,冰的能量高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
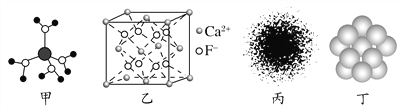
A. 水合铜离子的模型如图甲所示,1个水合铜离子中有4个配位键
B. CaF2晶体的晶胞如图乙所示,每个CaF2晶胞平均占有4个Ca2+
C. H原子的电子云图如图丙所示,H原子核外大多数电子在原子核附近运动
D. 金属Cu中Cu原子堆积模型如图丁所示,为最密堆积,每个Cu原子的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活、社会及环境密切相关。下列有关说法正确的是
A. 我国南海海底存储的可燃冰的成分为多种烷烃的混合物
B. 硅酸钠的水溶液俗名是水玻璃,可用于制备硅胶和木材防火剂
C. 柴油、煤油、“地沟油”等主要成分都属于烃类
D. 利用明矾对疫区污水进行消毒处理是利用了明矾中铝离子的水解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com