
| A. | Cl-、K+、HCO3-、Ca2+ | B. | OH-、NH4+、Mg2+、HCO3- | ||
| C. | SO32-、H+、Cl-、NO3- | D. | Na+、SiO32-、H+、Cl- |
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:解答题
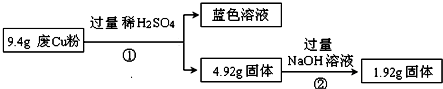

| 电解质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时的pH | 5.4 | 6.5 | 3.5 |
| 完全沉淀时的pH | 6.4 | 9.6 | 4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑧⑨ | B. | ①②③⑥⑦⑨ | C. | ①②③④⑥⑦⑨⑩ | D. | ①②③④⑥⑦⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用磁铁可以将Fe与Fe3O4分离 | |
| B. | 将生成的气体在空气中冷却可获得钠 | |
| C. | 该反应条件下铁的氧化性比钠强 | |
| D. | 每生成1molH2,转移的电子数约为4×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素、蛋白质均属于天然高分子化合物,水解产物都只有一种 | |
| B. | 油脂在碱性条件下水解属于皂化反应,酸性条件下的水解产物为甘油和高级脂肪酸 | |
| C. | 用pH计、电导率仪(一种测量溶液导电能力的仪器)均可监测乙酸乙酯的水解程度 | |
| D. | TiCl4+(x+2)H2O$\stackrel{△}{?}$TiO2•xH2O↓+4HCl 属于水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 苯(甲苯) | 酸性高锰酸钾溶液 NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
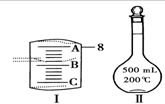 实验室要用Na2CO3•10H2O晶体配制500mLO.1mol•L-1Na2CO3溶液,回答下列问题:
实验室要用Na2CO3•10H2O晶体配制500mLO.1mol•L-1Na2CO3溶液,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X>Y>Z | |
| B. | 非金属性:X>Y>Z | |
| C. | 阴离子的还原性按X、Y、Z的顺序由强到弱 | |
| D. | 气态氢化物的稳定性按X、Y、Z的顺序由弱到强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com