
”¾ĢāÄæ”æ¾ŪŅŅĻ©“¼Čā¹šĖįõ„GæÉÓĆÓŚ¹āæĢ¹¤ŅÕÖŠ×÷æ¹øÆŹ“Ķæ²ć”£ĻĀĆęŹĒŅ»ÖÖŗĻ³ÉøĆÓŠ»śĪļµÄĀ·Ļߣزæ·Ö·“Ó¦Ģõ¼ž¼°²śĪļŅŃŹ”ĀŌ£©£ŗ
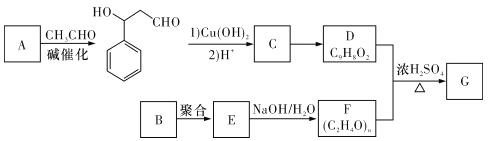
ŅŃÖŖŅŌĻĀŠÅĻ¢£ŗ
I£®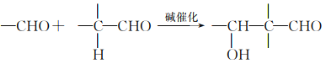 £»
£»
¢ņ.DÄÜŹ¹ĖįŠŌKMnO4ČÜŅŗĶŹÉ«£»
¢ó£®Ķ¬ĪĀĶ¬Ń¹ĻĀ£¬ŹµŃé²ā¶ØBĘųĢåµÄĆܶČÓėĘųĢ¬¼ŗĶéµÄĆܶČĻąĶ¬£¬BÖŠŗ¬ÓŠŅ»øöõ„»łŗĶŅ»øö¼×»ł”£
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
(I)AµÄ»ÆѧĆū³ĘŹĒ_________”£
(2)ÓÉCÉś³ÉDµÄ¹ż³ĢÖŠæÉÄÜÉś³É¶ąÖÖø±²śĪļ£¬ĘäÖŠÓėD»„ĪŖĶ¬·ÖŅģ¹¹ĢåµÄÓŠ»śĪļµÄ½į¹¹¼ņŹ½ĪŖ______”£
(3)BµÄ·Ö×ÓŹ½ĪŖ__________”£
(4)ÓÉDŗĶFÉś³ÉGµÄ»Æѧ·½³ĢŹ½ĪŖ_____________”£
(5)Āś×ćĻĀĮŠĢõ¼žµÄCµÄĶ¬·ÖŅģ¹¹ĢåÓŠ________Ö֣ز»æ¼ĀĒĮ¢ĢåŅģ¹¹£©”£
¢ŁøĆÓŠ»śĪļŹĒŅ»ÖÖ¶žŌŖČõĖį£¬²¢ÄÜŹ¹FeC13ČÜŅŗĻŌÉ«£»
¢Ś±½»·ÉĻÓŠČżøöČ”“ś»ł£¬²¢ÄÜ·¢ÉśŅų¾µ·“Ó¦”£
(6)ÓÉD¾ČēĻĀ²½ÖčæÉŗĻ³ÉK£ŗ
![]()
¢ŁHÖŠ¹ŁÄÜĶŵÄĆū³ĘĪŖ _______________”£
¢ŚIµÄ½į¹¹¼ņŹ½ĪŖ__________________”£
”¾“š°ø”æ ±½¼×Č© ![]() C4H6O2
C4H6O2  12 äåŌ×Ó”¢ōČ»ł
12 äåŌ×Ó”¢ōČ»ł 
”¾½āĪö”æøł¾ŻŠÅĻ¢I£®AĪŖ±½¼×Č©£¬A ÓėŅŅČ©·“Ӧɜ³É
ÓėŅŅČ©·“Ӧɜ³É ”¢ŌŚŠĀÖĘĒāŃõ»ÆĶŠü×ĒŅŗÖŠŃõ»ÆĪŖC
”¢ŌŚŠĀÖĘĒāŃõ»ÆĶŠü×ĒŅŗÖŠŃõ»ÆĪŖC ”¢C·¢ÉśĻūČ„·“Ӧɜ³ÉD
”¢C·¢ÉśĻūČ„·“Ӧɜ³ÉD ”¢BĪŖ
”¢BĪŖ ”¢B¾ŪŗĻÉś³ÉE
”¢B¾ŪŗĻÉś³ÉE ”¢EĖ®½āÉś³ÉF
”¢EĖ®½āÉś³ÉF ”¢FÓėD·¢Éśõ„»Æ·“Ӧɜ³ÉG
”¢FÓėD·¢Éśõ„»Æ·“Ӧɜ³ÉG ”£
ӣ
(I)AµÄ»ÆѧĆū³ĘŹĒ±½¼×Č©”£(2)ÓÉCÉś³ÉDµÄ¹ż³ĢÖŠæÉÄÜÉś³É¶ąÖÖø±²śĪļ£¬ĘäÖŠÓėD»„ĪŖĶ¬·ÖŅģ¹¹ĢåµÄÓŠ»śĪļµÄ½į¹¹¼ņŹ½ĪŖ![]() ”£(3)Ķ¬ĪĀĶ¬Ń¹ĻĀ£¬ŹµŃé²ā¶ØBĘųĢåµÄĆܶČÓėĘųĢ¬¼ŗĶéµÄĆܶČĻąĶ¬£¬BµÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ84£¬BÖŠŗ¬ÓŠŅ»øöõ„»ł-COO-ŗĶŅ»øö¼×»ł-CH3£¬²Š»łŹ½Įæ£ŗ84-16”Į2-12-15=27£¬ŗ¬2øöĢ¼£¬3øöH”£BµÄ·Ö×ÓŹ½ĪŖC4H6O2”£
”£(3)Ķ¬ĪĀĶ¬Ń¹ĻĀ£¬ŹµŃé²ā¶ØBĘųĢåµÄĆܶČÓėĘųĢ¬¼ŗĶéµÄĆܶČĻąĶ¬£¬BµÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ84£¬BÖŠŗ¬ÓŠŅ»øöõ„»ł-COO-ŗĶŅ»øö¼×»ł-CH3£¬²Š»łŹ½Įæ£ŗ84-16”Į2-12-15=27£¬ŗ¬2øöĢ¼£¬3øöH”£BµÄ·Ö×ÓŹ½ĪŖC4H6O2”£
(4)ÓÉD ŗĶF
ŗĶF ·¢Éśõ„»Æ·“Ӧɜ³ÉG
·¢Éśõ„»Æ·“Ӧɜ³ÉG £¬»Æѧ·½³ĢŹ½ĪŖ
£¬»Æѧ·½³ĢŹ½ĪŖ ”£(5)Āś×ćĻĀĮŠĢõ¼žµÄC
”£(5)Āś×ćĻĀĮŠĢõ¼žµÄC µÄĶ¬·ÖŅģ¹¹ĢåÓŠ12Ö֣ز»æ¼ĀĒĮ¢ĢåŅģ¹¹£©”£¢ŁøĆÓŠ»śĪļŹĒŅ»ÖÖ¶žŌŖČõĖį£¬²¢ÄÜŹ¹FeC13ČÜŅŗĻŌÉ«£¬ŗ¬ÓŠ·ÓōĒ»ł£»¢Ś±½»·ÉĻÓŠČżøöČ”“ś»ł£¬²¢ÄÜ·¢ÉśŅų¾µ·“Ó¦ŗ¬ÓŠ-CHO£¬×ŻÉĻĖłŹöÓ¦ŗ¬ÓŠĮ½øö·ÓōĒ»ł£¬Õż±ūČ©»łŗĶŅģ±ūČ©»ł”£±½¶ž·ÓÓŠČżÖÖ½į¹¹£¬
µÄĶ¬·ÖŅģ¹¹ĢåÓŠ12Ö֣ز»æ¼ĀĒĮ¢ĢåŅģ¹¹£©”£¢ŁøĆÓŠ»śĪļŹĒŅ»ÖÖ¶žŌŖČõĖį£¬²¢ÄÜŹ¹FeC13ČÜŅŗĻŌÉ«£¬ŗ¬ÓŠ·ÓōĒ»ł£»¢Ś±½»·ÉĻÓŠČżøöČ”“ś»ł£¬²¢ÄÜ·¢ÉśŅų¾µ·“Ó¦ŗ¬ÓŠ-CHO£¬×ŻÉĻĖłŹöÓ¦ŗ¬ÓŠĮ½øö·ÓōĒ»ł£¬Õż±ūČ©»łŗĶŅģ±ūČ©»ł”£±½¶ž·ÓÓŠČżÖÖ½į¹¹£¬ ”¢
Ӣ Ӣ
”¢ £¬±½»·ÉĻµÄ²»Ķ¬µÄĒā·Ö±šĪŖ2ÖÖ”¢3ÖÖ”¢1ÖÖ£¬Õż±ūČ©»łŗĶŅģ±ūČ©»łÓėÖ®ĻąĮ¬ø÷ŠĪ³É6ÖÖĶ¬·ÖŅģ¹¹Ģ壬¹²12ÖÖ”£(6)ÓÉD
£¬±½»·ÉĻµÄ²»Ķ¬µÄĒā·Ö±šĪŖ2ÖÖ”¢3ÖÖ”¢1ÖÖ£¬Õż±ūČ©»łŗĶŅģ±ūČ©»łÓėÖ®ĻąĮ¬ø÷ŠĪ³É6ÖÖĶ¬·ÖŅģ¹¹Ģ壬¹²12ÖÖ”£(6)ÓÉD ŗĻ³ÉK£ŗ¢Ł
ŗĻ³ÉK£ŗ¢Ł ÓėHBr·¢Éś¼Ó³É·“Ӧɜ³ÉH
ÓėHBr·¢Éś¼Ó³É·“Ӧɜ³ÉH £¬
£¬ ÖŠ¹ŁÄÜĶŵÄĆū³ĘĪŖ äåŌ×Ó”¢ōČ»ł”£¢Ś
ÖŠ¹ŁÄÜĶŵÄĆū³ĘĪŖ äåŌ×Ó”¢ōČ»ł”£¢Ś ŌŚNaOHÖŠĖ®½āÉś³ÉI£¬IµÄ½į¹¹¼ņŹ½ĪŖ
ŌŚNaOHÖŠĖ®½āÉś³ÉI£¬IµÄ½į¹¹¼ņŹ½ĪŖ ”£
ӣ



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹŠŌÖŹµÄ±ä»Æ¹ęĀÉÓė·Ö×Ó¼ä×÷ÓĆĮ¦ÓŠ¹ŲµÄŹĒ£Ø £©
A£®HF”¢HCl”¢HBr”¢HIµÄČČĪČ¶ØŠŌŅĄ“Ī¼õČõ
B£®½šøÕŹÆµÄÓ²¶Č“óÓŚ¹č£¬ĘäČŪ”¢·ŠµćŅ²øßÓŚ¹č
C£®NaF”¢NaCl”¢NaBr”¢NalµÄČŪµćŅĄ“Ī½µµĶ
D£®F2”¢Cl2”¢Br2”¢I2µÄČŪ”¢·ŠµćÖš½„Éżøß
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ(Ņ»)ŌŚČŻ»żĪŖ5LµÄĆܱÕČŻĘ÷ÖŠ£¬ĶØČė5 mol N2ŗĶ8 mol H2£¬ŌŚŅ»¶ØĢõ¼žĻĀ·“Ӧɜ³ÉNH3£¬µ±·“Ó¦½ųŠŠµ½2 minŹ±£¬²āµĆČŻĘ÷ÄŚÓŠ4 mol NH3”£Ōņ£ŗ
(1)2 minŹ±£¬ČŻĘ÷ÄŚn(N2)== ________ £¬c(H2)== ___________ ”£
(2)2 minŹ±£¬ČŻĘ÷ÄŚĘųĢåµÄ×ÜĪļÖŹµÄĮæÓė·“Ó¦Ē°ČŻĘ÷ÄŚĘųĢåµÄ×ÜĪļÖŹµÄĮæÖ®±ČĪŖ _______ ”£
(¶ž)A”¢B”¢C”¢DĖÄÖÖ¶ĢÖÜĘŚŌŖĖŲ£¬ĖüĆĒµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó£¬ĘäÖŠAÓėC¼°BÓėD·Ö±šŹĒĶ¬Ö÷×åŌŖĖŲ£»ŅŃÖŖB”¢DĮ½ŌŖĖŲ¼äæÉŠĪ³ÉDB2ŗĶDB3Į½ÖÖ»ÆŗĻĪļ£¬Į½ÕßĻą¶Ō·Ö×ÓÖŹĮæĻą²ī16£»ÓÖÖŖA”¢CĮ½ŌŖĖŲŌ×ÓŠņŹżÖ®ŗĶŹĒB”¢DĮ½ŌŖĖŲŌ×ÓŠņŹżÖ®ŗĶµÄŅ»°ė”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)Š“³öÓÉA”¢B”¢CČżŌŖĖŲŠĪ³ÉµÄ»ÆŗĻĪļµÄµē×ÓŹ½__________ £¬
(2)ÓÉA”¢B”¢C”¢DĖÄÖÖŌŖĖŲŠĪ³ÉµÄĪļÖŹX£¬ÓėŃĪĖį·“Ó¦Äܹ»Éś³É¾ßÓŠ“Ģ¼¤ŠŌĘųĪ¶µÄĘųĢ壬Š“³öXÓėŃĪĖį·“Ó¦µÄĄė×Ó·½³ĢŹ½________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³£ĪĀĻĀĻņ100 mL0.1mol/LµÄNaOHČÜŅŗÖŠĶØČėŅ»¶ØĮæµÄCO2”£ĪŖĢ½¾æ·“Ó¦ŗó»ģŗĻČÜŅŗµÄ³É·Ö£¬ĻņĘäÖŠÖšµĪ¼ÓČė0.1 mol/LµÄHClČÜŅŗ”£ČÜŅŗ²śÉśĘųĢåĒ°£¬ĻūŗÄV( HCl)=V1£»ČÜŅŗøÕŗĆ²»ŌŁ²śÉśĘųĢåŹ±£¬ĻūŗÄV( HCl) =V2”£µ±V1 <V2 <2VlŹ±£¬»ģŗĻČÜŅŗÖŠČÜÖŹµÄ³É·ÖĪŖ
A. NaHCO3ӢNa2CO3 B. NaOHӢNaHCO3 C. NaOHӢNa2CO3 D. NaOHӢNa2CO3ӢNaHCO3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČĖĢåĻø°ūÖŠŗĖĖįµÄŗĖÜÕĖįÖÖĄąŹżŅŌ¼°¼ī»łÖÖĄąŹż·Ö±šŹĒ£Ø £©
A. 4 , 5 B. 5 , 8 C. 8 , 4 D. 8 , 5
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻņ50 mL 14.0 molL©1ÅØĻõĖįÖŠ¼ÓČė×ćĮæĶ£¬³ä·Ö·“Ó¦ŗó¹²ŹÕ¼Æµ½±ź×¼×“æöĻĀ4.48 L NOŗĶNO2»ģŗĻĘųĢå£Ø²»æ¼ĀĒNO2ÓėN2O4µÄĻą»„×Ŗ»Æ£©£¬Ōņ²Ī¼Ó·“Ó¦ĶµÄÖŹĮæĪŖ
A. 6.4gB. 12.8gC. 16.0gD. 19.2g
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŠšŹöÖŠ£¬ÕżČ·µÄŹĒ
A. 1sµē×ÓŌĘ½ēĆęĶ¼ŹĒŅ»øöĒņĆę£¬±ķŹ¾ŌŚÕāøöĒņĆęŅŌÄŚ£¬µē×Ó³öĻÖµÄøÅĀŹĪŖ![]()
B. ŌŚÄÜ²ć”¢Äܼ¶”¢ŅŌ¼°µē×ÓŌʵÄÉģÕ¹·½ĻņČ·¶ØŹ±£¬µē×ÓµÄŌĖ¶ÆדĢ¬²ÅÄÜČ·¶ØĻĀĄ“
C. ŌŚĻÖ“ś»Æѧ֊£¬³£ĄūÓĆŌ×Ó¹āĘ×ÉĻµÄĢŲÕ÷Ę×Ļߥ“¼ų¶ØŌŖĖŲ£¬³ĘĪŖ¹āĘ×·ÖĪö
D. Ō×ÓŗĖĶāµÄµē×Ó¾ĶĻńŠŠŠĒĪ§ČĘĢ«ŃōŅ»ŃłČĘ×ÅŌ×ÓŗĖ×öŌ²ÖÜŌĖ¶Æ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¶Ō¹¤Ņµ·ĻĖ®ŗĶÉś»īĪŪĖ®½ųŠŠ“¦ĄķŹĒ·ĄÖ¹Ė®ĢåĪŪČ¾”¢øÄÉĘĖ®ÖŹµÄÖ÷ŅŖ“ėŹ©Ö®Ņ»”£
(1)ĮņĖį³§µÄĖįŠŌ·ĻĖ®ÖŠÉé(As)ŌŖĖŲ(Ö÷ŅŖŅŌH3AsO3ŠĪŹ½“ęŌŚ)ŗ¬Į漫øߣ¬ĪŖæŲÖĘÉéµÄÅÅ·Å£¬Ä³¹¤³§²ÉÓĆ»Æѧ³Įµķ·Ø“¦Ąķŗ¬Éé·ĻĖ®”£Ēė»Ų“šŅŌĻĀĪŹĢā£ŗ
¢ŁŅŃÖŖÉéŹĒµŖµÄĶ¬×åŌŖĖŲ£¬±ČµŖŌ×Ó¶ą2øöµē×Ó²ć£¬ÉéŌŚŌŖĖŲÖÜĘŚ±ķµÄĪ»ÖĆĪŖ____________”£
¢Ś¹¤ŅµÉĻ²ÉÓĆĮņ»Æ·Ø(Ķس£ÓĆĮņ»ÆÄĘ)Č„³ż·ĻĖ®ÖŠµÄÉé£¬Éś³ÉĪļĪŖÄŃČÜŠŌµÄČżĮņ»Æ¶žÉ飬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ_____________________”£
(2)µē¶Ę³§µÄ·ĻĖ®ÖŠŗ¬ÓŠµÄCN-ÓŠ¾ē¶¾£¬ŠčŅŖ“¦Ąķ¼ÓŅŌÅÅ·Å”£“¦Ąķŗ¬CN-·ĻĖ®µÄ·½·ØÖ®Ņ»ŹĒŌŚĪ¢ÉśĪļµÄ×÷ÓĆĻĀ£¬CN-±»ŃõĘųŃõ»Æ³ÉHCO3-£¬Ķ¬Ź±Éś³ÉNH3£¬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ_____________”£
(3)µēÉųĪö·Ø“¦Ąķ³ų·æĄ¬¼«·¢½ĶŅŗ£¬Ķ¬Ź±µĆµ½ČéĖįµÄŌĄķČēĶ¼ĖłŹ¾(Ķ¼ÖŠ”°HA”±±ķŹ¾ČéĖį·Ö×Ó£¬A-±ķŹ¾ČéĖįøłĄė×Ó)£ŗ
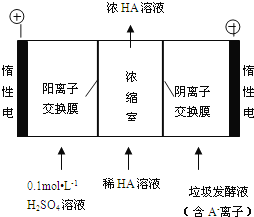
¢ŁŃō¼«µÄµē¼«·“Ó¦Ź½ĪŖ________________________”£
¢Ś¼ņŹöÅØĖõŹŅÖŠµĆµ½ÅØČéĖįµÄŌĄķ£ŗ________________________”£
¢Ūµē½ā¹ż³ĢÖŠ£¬²ÉČ”Ņ»¶ØµÄ“ėŹ©æÉæŲÖĘŃō¼«ŹŅµÄpHŌ¼ĪŖ6”«8£¬“ĖŹ±½ųČėÅØĖõŹŅµÄOH-æÉŗöĀŌ²»¼Ę”£400 mL 10 g/L ČéĖįČÜŅŗĶصēŅ»¶ĪŹ±¼äŗó£¬ÅضČÉĻÉżĪŖ145 g/L(ČÜŅŗĢå»ż±ä»ÆŗöĀŌ²»¼Ę)£¬Ņõ¼«ÉĻ²śÉśµÄH2ŌŚ±ź×¼×“æöĻĀµÄĢå»żŌ¼ĪŖ________L(ĢįŹ¾£ŗČéĖįµÄĦ¶ūÖŹĮæĪŖ90 g/mol)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀ±ķŹĒŌŖĖŲÖÜĘŚ±ķµÄŅ»²æ·Ö”£±ķÖŠĖłĮŠµÄ×ÖÄø·Ö±š“ś±ķŅ»ÖÖ»ÆѧŌŖĖŲ”£
a | |||||||||||||||||
b | c | d | e | f | |||||||||||||
g | h | i | j | k | l | m | |||||||||||
n | o | p | |||||||||||||||
ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ŌŖĖŲpĪŖ26ŗÅŌŖĖŲ£¬ĒėŠ“³öĘ仳Ģ¬Ō×ÓĶāĪ§µē×ÓÅŲ¼Ź½£ŗ____”£
£Ø2£©cÓėaŠĪ³É6øöŌ×Ó×é³É·Ö×Ó½į¹¹¼ņŹ½£ŗ__________£¬øĆ·Ö×ÓŹĒ£ŗ_______£ØĢī”°¼«ŠŌ”±»ņ”°·Ē¼«ŠŌ”±£©·Ö×Ó”£
£Ø3£©±ķÖŠO”¢PĮ½ŌŖĖŲµÄ²æ·ÖµēĄėÄÜŹż¾ŻĮŠÓŚĻĀ±ķ£ŗ
ŌŖ ĖŲ | O | P | |
µēĄėÄÜkJ”¤mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
±Č½ĻĮ½ŌŖĖŲµÄI2”¢I3æÉÖŖ£¬ĘųĢ¬O2+ŌŁŹ§Č„Ņ»øöµē×Ó±ČĘųĢ¬P2+ŌŁŹ§Č„Ņ»øöµē×ÓÄŃ”£¶Ō“Ė£¬ÄćµÄ½āŹĶŹĒ__________________________£»
£Ø4£©iµ„ÖŹ¾§ĢåÖŠŌ×ӵĶѻż·½Ź½ČēĻĀĶ¼¼×ĖłŹ¾£¬Ę侧°ūĢŲÕ÷ČēĻĀĶ¼ŅŅĖłŹ¾£¬Ō×ÓÖ®¼äĻą»„Ī»ÖĆ¹ŲĻµµÄĘ½ĆęĶ¼ČēĻĀĶ¼±ūĖłŹ¾”£
¾§°ūÖŠiŌ×ÓµÄÅäĪ»ŹżĪŖ___________£¬Ņ»øö¾§°ūÖŠiŌ×ӵďżÄæĪŖ____________”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com