
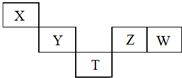
 X~T元素在周期表中的相对位置如图所示,其中X、Y、Z、W元素原子的最外层电子数之和为20,T为第4周期元素.下列说法正确的是( )
X~T元素在周期表中的相对位置如图所示,其中X、Y、Z、W元素原子的最外层电子数之和为20,T为第4周期元素.下列说法正确的是( )| A. | YW4与H2在高温下反应主要生成YH4和HW | |
| B. | X的原子半径比T原子半径小,两者原子序数之差为29 | |
| C. | W氧化物的水化物的酸性一定强于Z的氧化物的水化物 | |
| D. | T的氢化物可能具有强的还原性,其稳定性小于Z的氢化物 |
分析 T为第4周期元素,结合位置关系可知,X为第二周期元素,则Y、Z、W均为第三周期元素,X、Y、Z、W元素原子的最外层电子数之和为20,设X的最外层电子数为x,则x+x+1+x+3+x+4=20,解得x=3,则X为B,Y为Si,T为As,Z为S,W为Cl,然后结合元素周期律及元素化合物知识来解答.
解答 解:T为第4周期元素,结合位置关系可知,X为第二周期元素,则Y、Z、W均为第三周期元素,X、Y、Z、W元素原子的最外层电子数之和为20,设X的最外层电子数为x,则x+x+1+x+3+x+4=20,解得x=3,则X为B,Y为Si,T为As,Z为S,W为Cl,
A.SiCl4与H2在高温下反应主要生成Si和HCl,故A错误;
B.电子层越多,原子半径越大,X的原子半径比T原子半径小,两者原子序数之差为33-4=29,故B正确;
C.由非金属性可知,W最高价氧化物的水化物的酸性一定强于Z的最高价氧化物的水化物,不是最高价无此规律,故C错误;
D.非金属性S>As,As的氢化物中As元素的化合价为最低价,则T的氢化物可能具有强的还原性,其稳定性小于Z的氢化物,故D正确;
故选BD.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、最外层电子数关系推断元素为解答的关键,对学生的逻辑推理有一定的要求,侧重分析与推断能力的综合考查,题目难度中等.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:实验题
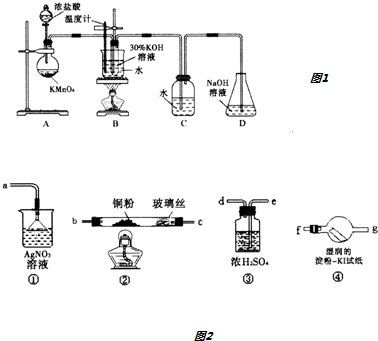
| 试管编号 | 1 | 2 | 3 | 4 |
| 0.20mol•L-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
| KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
| 6.0mol•L-1H2SO4/ml | 0 | 3.0 | 6.0 | 9.0 |
| 蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeO | B. | Fe2O3 | C. | Fe3O4 | D. | FeO和Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
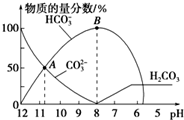 常温下,在10mL0.1mol•L-1Na2CO3溶液中逐渐加入0.1mol•L-1的盐酸,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数的变化如图所示(CO2因逸出未画出,忽略气体逸出而引起的溶液体积变化),下列说法正确的是( )
常温下,在10mL0.1mol•L-1Na2CO3溶液中逐渐加入0.1mol•L-1的盐酸,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数的变化如图所示(CO2因逸出未画出,忽略气体逸出而引起的溶液体积变化),下列说法正确的是( )| A. | 在A点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | 在B点所示的溶液中,浓度最大的离子是HCO3- | |
| C. | 当溶液的pH为7时,溶液中的阴离子只有两种 | |
| D. | 25℃时,HCO3-的电离平衡常数Ka=5×10-11,当溶液的pH=10时,c(HCO3-)=2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
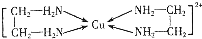 第四周期金属Cr、Fe、Cu在科学研究和工业生产中都有重要的用途.请回答下列问题:
第四周期金属Cr、Fe、Cu在科学研究和工业生产中都有重要的用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该 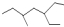 有机物的系统命名为:3-乙基-5-甲基庚烷 有机物的系统命名为:3-乙基-5-甲基庚烷 | |
| B. | 棉花、羊毛、合成纤维、油脂的成分都是高分子化合物 | |
| C. | 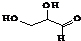 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 | |
| D. | 等质量的乙烯和乙醇完全燃烧消耗氧气的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中Fe2+是还原剂,O2是还原产物 | |
| B. | 4 mol Na2O2在反应中共得到8NA个电子 | |
| C. | 每生成0.2 mol O2,则被Fe2+还原的氧化剂为0.4 mol | |
| D. | 反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -824.4kJ•mol-1 | B. | -627.6kJ•mol-1 | C. | -744.7kJ•mol-1 | D. | -169.4kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 电离能序号 | I1 | I2 | I3 | I4 |
| 电离能(kJ/mol) | 740 | 1500 | 7700 | 10500 |
| A. | s区 | B. | p区 | C. | d区 | D. | ds区 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com