
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |

| c(碱)×V(碱) |
| V(酸) |
| V(标准)×c(标准) |
| V(待测) |
| 22.62mL+22.72mL+22.80mL |
| 3 |
| 0.10mol/L×22.72mL |
| 20.00mL |
| V(标准)×c(标准) |
| V(待测) |
| V(标准)×c(标准) |
| V(待测) |
| V(标准)×c(标准) |
| V(待测) |
| V(标准)×c(标准) |
| V(待测) |
| V(标准)×c(标准) |
| V(待测) |
| V(标准)×c(标准) |
| V(待测) |
| V(标准)×c(标准) |
| V(待测) |


科目:高中化学 来源: 题型:
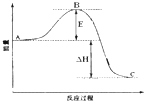 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.下列说法正确的是( )
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.下列说法正确的是( )| A、图中A、C分别表示反应物总能量和生成物总能量 | ||
| B、加入催化剂,图中E和△H都减小 | ||
| C、图中△H=-99kJ?mol-1 | ||
D、SO3(g)?
|
查看答案和解析>>
科目:高中化学 来源: 题型:
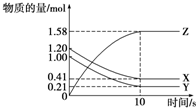 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )| A、反应开始到10 s,用Z表示的平均反应速率为0.158 mol?L-1?s-1 |
| B、反应开始到10 s,X的物质的量浓度减少了0.79 mol?L-1 |
| C、反应开始到10 s,Y的物质的量浓度减少了0.395 mol?L-1 |
| D、反应的化学方程式为X(g)+Y(g)?Z(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
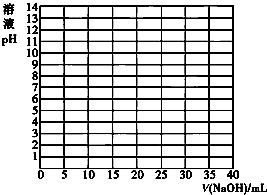 酸碱中和滴定常用于测定酸碱溶液的浓度.
酸碱中和滴定常用于测定酸碱溶液的浓度.| V/(NaOH)/mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
| 溶液pH | 2.87 | 4.74 | 5.70 | 6.74 | 7.74 | 8.72 | 9.70 | 10.70 | 11.70 | 12.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
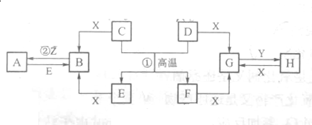 已知D、E、Z是单质,其他都是化合物.D既能与强酸反应,又能与强碱反应;潮湿的Z有漂白性;Y的焰色反应显黄色.除反应①外,其他反应均在水溶液中进行,转化关系如图所示(部分物质条件已略去).
已知D、E、Z是单质,其他都是化合物.D既能与强酸反应,又能与强碱反应;潮湿的Z有漂白性;Y的焰色反应显黄色.除反应①外,其他反应均在水溶液中进行,转化关系如图所示(部分物质条件已略去).查看答案和解析>>
科目:高中化学 来源: 题型:
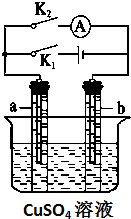 如图所示,某同学按照图装置进行如下实验,请回答下列问题:
如图所示,某同学按照图装置进行如下实验,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
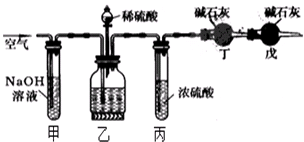 工业生产的纯碱中常含有少量的NaCl杂质,某校研究性活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置,先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数.
工业生产的纯碱中常含有少量的NaCl杂质,某校研究性活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置,先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com