
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
分析 (1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比,注意固体、纯液体不需要写出;
(2)由反应方程式知,消耗的H2与生成的水的物质的量相等,假定H2与水蒸气的物质的量分别为2mol、3mol,再根据转化率定义计算;
随温度的升高,H2与水蒸气的体积比减小,说明平衡向正反应移动;
(3)由表中主要成分与温度关系可知,第一阶段反应为WO3与H2反应是W2O5,同时还生成H2O,配平书写方程式;
580℃时,温度介于550℃~600℃,固体为W2O5、WO2的混合物;
根据三个阶段的方程式进行计算三个阶段消耗H2物质的量之比;
(4)已知:①WO2(s)+2H2(g)═W(s)+2H2O (g)△H=+66.0kJ•mol-1
②WO2(g)+2H2(g)═W(s)+2H2O (g)△H=-137.9kJ•mol-1
根据盖斯定律,①-②可得:WO2(s)═WO2(g),反应热也进行相应的运算;
(5)由化学方程式知,挥发的W与I2结合形成气态WI4,由于气体运动的结果,WI4会与还没有挥发的W接触,在高温下WI4分解生成的W附着在还没有挥发的W上,灯管壁温度较低,WI4不会分解,升高温度,正逆反应速率都加快.
解答 解:(1)WO3(s)+3H2(g)$\stackrel{高温}{?}$ W(s)+3H2O(g)的平衡常数k=$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$,故答案为:$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$;
(2)由反应方程式知,消耗的H2与生成的水的物质的量相等,故H2的平衡转化率为$\frac{3mol}{2mol+3mol}$×100%=60%,
升高温度,H2与水蒸气的体积比减小,说明升温时平衡向右移动,故正反应为吸热反应,
故答案为:60%;吸热;
(3)由表中主要成分与温度关系可知,第一阶段反应为WO3与H2反应是W2O5,同时还生成H2O,反应方程式为:
2WO3+H2$\frac{\underline{\;高温\;}}{\;}$W2O5+H2O,580℃时,温度介于550℃~600℃,固体为W2O5、WO2的混合物;
假定有2molWO3,由2WO3+H2$\frac{\underline{\;高温\;}}{\;}$W2O5+H2O、W2O5+H2?$\frac{\underline{\;高温\;}}{\;}$2WO2+H2O、WO2+2H2?$\frac{\underline{\;高温\;}}{\;}$ W+2H2O可知,三个阶段消耗的氢气的物质的量之比为1mol:1mol:2mol×2=1:1:4,
故答案为:2WO3+H2$\frac{\underline{\;高温\;}}{\;}$W2O5+H2O;W2O5、WO2;1:1:4;
(4)已知:①WO2 (s)+2H2 (g)?W (s)+2H2O (g);△H=+66.0kJ•mol-1
②WO2 (g)+2H2?W (s)+2H2O (g);△H=-137.9kJ•mol-1
①-②得则WO2 (s)?WO2 (g),故△H=66.0kJ•mol-1-(-137.9kJ•mol-1)=+203.9 kJ•mol-1,
故答案为:+203.9 kJ•mol-1;
(5)由所给化学方程式知,挥发的W与I2结合形成气态WI4,由于气体运动的结果,WI4会与还没有挥发的W接触,在高温下WI4分解生成的W及I2,生成W附着在还没有挥发的W上,灯管内的I2可循环使用,故a、b对;灯管壁温度较低,WI4不会分解,故c错;升高温度,也能加快W与I2的反应速率,故d错,
故答案为:a、b.
点评 本题考查化学平衡常数的书写、反应热的计算、化学平衡移动原理、化学平衡计算等,题目选择的素材比较陌生,以考查学生的能力为主,难度中等.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 锌电极发生还原反应:铜电极发生氧化反应 | |
| B. | 铜电极做正极发生的电极反应为:2H++2e-═H2↑ | |
| C. | 当有13g Zn溶解时,电路中就有0.5mol电子通过 | |
| D. | 电子从锌电极通过电流表流向铜电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
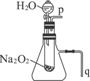 教材中有一个演示实验:用脱脂棉包住约0.2g Na2O2粉末,置于石棉网上,可观察到脱脂棉燃烧起来.
教材中有一个演示实验:用脱脂棉包住约0.2g Na2O2粉末,置于石棉网上,可观察到脱脂棉燃烧起来.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
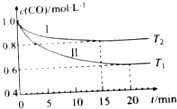 为了减少CO对大气的污染,某科研小组在一个体积为1L的容积不变的密闭容器中充入等量的CO和H2O(g),研究用CO和H2O(g)反应转化为绿色能源H2,不同温度下,CO的浓度[c(CO)]随时间[t]变化的曲线如图所示.
为了减少CO对大气的污染,某科研小组在一个体积为1L的容积不变的密闭容器中充入等量的CO和H2O(g),研究用CO和H2O(g)反应转化为绿色能源H2,不同温度下,CO的浓度[c(CO)]随时间[t]变化的曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
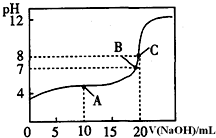 (1)pH=13的CH3COONa溶液加水稀释100倍后,pH>11(填“>”“=”或“<”),原因是醋酸根离子水解溶液显碱性,CH3COO-+H2O?CH3COOH+OH-,加水稀释后醋酸根离子的水解程度增大,氢氧根离子浓度略有增大,则溶液的pH>11(用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH>NaOH溶液的pH(填“>”“=”或“<”);
(1)pH=13的CH3COONa溶液加水稀释100倍后,pH>11(填“>”“=”或“<”),原因是醋酸根离子水解溶液显碱性,CH3COO-+H2O?CH3COOH+OH-,加水稀释后醋酸根离子的水解程度增大,氢氧根离子浓度略有增大,则溶液的pH>11(用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH>NaOH溶液的pH(填“>”“=”或“<”);查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com