
����Ŀ�������ȣ�SO2Cl2������Ҫ�Ļ�ѧ�Լ����������·�Ӧ��ȡ��SO2��g��+Cl2��g��![]() SO2Cl2��g����H��Ը÷�Ӧ�ش��������⣺
SO2Cl2��g����H��Ը÷�Ӧ�ش��������⣺
��1����֪����SO2��g��+Cl2��g��+SCl2��g��![]() 2SOCl2��g����H1=��akJmol��1
2SOCl2��g����H1=��akJmol��1
��SO2Cl2+SCl2��g��=2SOCl2��g����H2=��bkJmol��1
��a��b��0����H=______kJmol��1���ú�a��b�Ĵ���ʽ��ʾ��
��2��Ϊ����߸÷�Ӧ��Cl2��ƽ��ת���ʣ����д�ʩ��������______������ĸ��ţ���
a����С���������b��ʹ�ô�����c������SO2Ũ�ȡ�d�������¶�
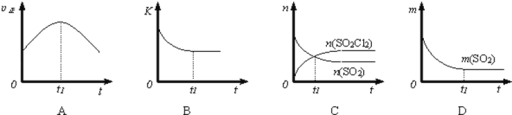
��3�����ھ��ȡ����ݵ��ܱ���ϵ�У�Ͷ��һ����SO2��Cl2�������÷�Ӧ������ʾ��ͼ��˵��t1ʱ�̷�Ӧ�ﵽƽ��״̬����______������ĸ��ţ�������ͼ��������K��n��m�ֱ��ʾ����Ӧ���ʡ�ƽ�ⳣ�������ʵ�����������
��4�����ڴ��������£���nmolSO2��nmolCl2�����ݻ��ɱ���ܱ������У���ʼ�ձ����¶�ΪT��ѹǿΪP����ʼʱ���������Ϊ10L��t minʱ��Ӧ�ﵽƽ��״̬����ʱ���������Ϊ8L��
�����ݻ��ı�������£���Ӧ���ʿ��õ�λʱ���ڷ�Ӧ�������������ʵ����仯����ʾ��������SO2��=____��
�����¶��£��÷�Ӧ��K=___��
����ͬ�����£�����0.5nmolSO2��0.5nmolCl2���������������ƽ��״̬ʱ���������SO2Cl2�����ʵ�����____��
��5���÷�Ӧ�IJ���SO2Cl2��ˮ��������ˮ����������ǿ�ᣬд���仯ѧ����ʽ____����֪25��ʱ��Ksp[AgCl]=1.8��10��10��Ksp[Ag2SO4]=1.4��10��5����SO2Cl2��ˮ������Һ����μ���AgNO3ϡ��Һʱ�����Ȳ����ij�����______��
���𰸡�����a��b�� AC BD ![]() mol/min
mol/min ![]() L/mol 0.2nmol SO2Cl2+2H2O=H2SO4+2HCl AgCl
L/mol 0.2nmol SO2Cl2+2H2O=H2SO4+2HCl AgCl
��������
(1)��SO2(g)+Cl2(g)+SCl2(g)2SOCl2(g)��H1=a kJmol��1
��SO2Cl2+SCl2(g)=2SOCl2(g)��H2=b kJmol��1
��˹���ɼ�����ڵõ���SO2(g)+Cl2(g)SO2Cl2(g)��H=(ab) kJmol��1��
�ʴ�Ϊ��(ab)��
(2)��߷�Ӧ��Cl2��ƽ��ת���ʣ��ı�����ʹƽ��������Ӧ�ƶ�����������������������
A. ��С�������,ѹǿ����,ƽ��������Ӧ�ƶ�,Cl2��ת��������A��ȷ��
B. ʹ�ô���,���̵���ƽ���ʱ��,��Ӱ��ƽ���ƶ�,Cl2��ת���ʲ��䣬��B����
C. ����SO2Ũ��,ƽ��������Ӧ�ƶ�,Cl2��ת��������C��ȷ��
D. �÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ,�����¶�,ƽ�����淴Ӧ�ƶ�,Cl2��ת���ʽ��ͣ���D����
�ʴ�Ϊ��AC��
(3)A������ƽ���������������ȣ����ٱ仯��t1ʱ��V�����֮�����ʲ��䣬��a����
B. �÷�Ӧ����ӦΪ���ȷ�Ӧ���淴Ӧ�����¶����ߣ���ѧƽ�ⳣ����С������ƽ����¶�Ϊ��ֵ��ƽ�ⳣ�����䣬Ϊ��С��ͼ����ʵ�ʷ��ϣ���B��ȷ��
C.t1ʱ�̺�SO2(g)��SO2Cl2(g)�����ʵ��������仯��t1ʱ��δ����ƽ��״̬����C����
D.t1ʱ��,SO2������Ϊ��ֵ������ƽ��״̬��ͼ����ʵ�ʷ��ϣ���D��ȷ��
��ѡBD��
(4)���ڴ��������£���nmolSO2��nmolCl2�����ݻ��ɱ���ܱ������У���ʼ�ձ����¶�ΪT��ѹǿΪP����ʼʱ���������Ϊ10L��tminʱ��Ӧ�ﵽƽ��״̬����ʱ���������Ϊ8L����μӷ�Ӧ�Ķ����������ʵ���Ϊx��
SO2(g)+Cl2(g)SO2Cl2(g)
��ʼ��(mol) n n 0
�仯��(mol) x x x
ƽ����(mol) nx nx x
�����¶�ΪT��ѹǿΪP���������֮�ȵ����������ʵ���֮�ȣ�2n:(2nx)=10:8��
x=0.4n��
�� ���ݻ��ı�������£���Ӧ���ʿ��õ�λʱ���ڷ�Ӧ�������������ʵ����仯����ʾ��
����(SO2)= ![]() mol/min���ʴ�Ϊ��
mol/min���ʴ�Ϊ��![]() mol/min��
mol/min��
���ݢٽ��ƽ��������,K�T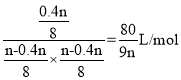 ��
��
�ʴ�Ϊ��![]() ��
��
�� ��nmolSO2��nmolCl2�����ݻ��ɱ���ܱ�������,�õ�SO2Cl20.4nmol�����ѹ������
����������ϵ����ͬ�����£�����0.5nmolSO2��0.5nmolCl2���������,����ƽ��״̬ʱ�����Ķ����������ʵ���Ϊ0.2n���������SO2Cl2�����ʵ�����0.2nmol��
�ʴ�Ϊ��0.2nmol��
(5)SO2Cl2��ˮ��������ˮ��,�Ҳ���������������ˮ������HCl�������ˮ����������£���SO2���Ž��2��OH����H2SO4,��Ӧ����ʽΪ��SO2Cl2+2H2O=H2SO4+2HCl
�ʴ�Ϊ��SO2Cl2+2H2O=H2SO4+2HCl��AgCl��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����FeO��Fe2O3�Ļ�������ɿˣ�������H2�����м��ȳ�ַ�Ӧ����ȴ��Ƶ�ʣ������ԭ��������0.8g������������ԭ����������ᷴӦ����ʹ֮��ȫ�ܽ�, ������Ҫ1molL��1����������Ϊ�� ��
A. 0.05 LB. 0.1 LC. 0.2 LD. 1 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����º����£���2molA�����2molB����ͨ�����Ϊ2L���ܱ������з������·�Ӧ��2A(g)+B(g)![]() xC(g)+2D(s)��2minʱ��Ӧ�ﵽƽ��״̬����ʱʣ��1.2molB�������C��Ũ��Ϊ1.2mo1��L��1��
xC(g)+2D(s)��2minʱ��Ӧ�ﵽƽ��״̬����ʱʣ��1.2molB�������C��Ũ��Ϊ1.2mo1��L��1��
(1)�ӿ�ʼ��Ӧ���ﵽƽ��״̬������C��ƽ����Ӧ����Ϊ____________________��
(2)x =________��
(3)A��ת������B��ת����֮��Ϊ___________��
(4)���и������Ϊ�÷�Ӧ�ﵽƽ��״̬�ı�־����_________��
A��ѹǿ���ٱ仯
B�������ܶȲ��ٱ仯
C������ƽ����Է����������ٱ仯
D��A������������B����������֮��Ϊ2��1
(5)��ʹ��Ӧ�ﵽƽ��ʱ��C�����ʵ�������������ƽ����ȣ���ʼ����A��B�����ʵ���n(A)��n(B)֮��Ӧ����Ĺ�ϵΪ ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ø�Ч�Ķ�������(ClO2)���Һ�Ƚ����������ɱ�����������彡���к����л��ȴ��
��1����ҵ�ϣ�ClO2����NaClO3��Na2SO3��Һ��ϲ��������ữ��Ӧ�Ƶã���ѧ��Ӧ����ʽΪ___���ڸ÷�Ӧ��NaClO3��Na2SO3�����ʵ���֮��Ϊ________��
��2����Ч�Ⱥ����Ǻ�����������һ����Ҫָ�꣬��Ч�Ⱥ����Ķ��壺��HI����������ͬ����I2����Cl2��������ָ������������������֮�ȣ����ðٷ�����ʾ����ClO2����Ч�Ⱥ�����________��
��3����ѧС���ͬѧ������ClO2������������ˮ������Ԫ�غ����IJⶨ(�ٶ�ClO2ȫ��ת��ΪCl��)�����ǽ���������ʵ�飺��30.00 mLˮ���мӼ���K2CrO4��Һ��ָʾ������0.001 mol��L��1AgNO3��Һ�ζ�������ש��ɫAg2CrO4��������ʱ����ζ��յ㣬��ʱ��ȥAgNO3��Һ12.12 mL��
��ˮ����Cl�������ʵ���Ũ����________��
����֪Ksp(AgCl)��1.780��10��10��Ksp(Ag2CrO4)��2.00��10��12�����ڵζ��յ�ʱ�������Һ��CrO42-��Ũ����5.000��10��3mol��L��1���Լ����ʱ��Һ��Cl����Ũ����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��������ۻ������Ӽ�˷���__�������������������ۻ������Ӽ�˷���__����������������������Ӽ�˷���__�������������־�����۵��ɸߵ��͵�˳����__��
��2���������־��壺��CO2����NaCl����Na����Si����CS2�����ʯ�����ǵ��۵�ӵ͵��ߵ�˳��Ϊ__������ţ���
��3����H2����NH4��2SO4��SiC��CO2��HF�У��ɼ��Լ��γɵķǼ��Է�����__���ɷǼ��Լ��γɵķǼ��Է�����__�����γɷ��Ӿ����������__����������ľ���Ļ�ѧʽ��__���������Ӿ������__������ԭ�Ӿ������__���������ʵ��۵��ɸߵ��͵�˳����__��
��4��A��B��C��DΪ���־��壬�������£�
A����̬ʱ�ܵ��磬����������
B��������CS2��������ˮ
C����̬ʱ�����磬Һ̬ʱ�ܵ��磬������ˮ
D����̬��Һ̬ʱ�������磬�۵�Ϊ3 500��
���ƶ����ǵľ������ͣ�A��__��B��__��C��__��D��__��
��5��ͼ��A��D����ѧ��ѧ�̿����ϳ����ļ��־���ṹģ�ͣ�����д��Ӧ���ʵ����ƣ�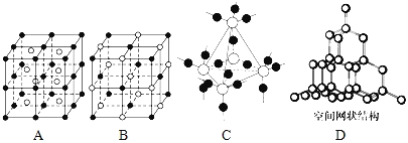
A��__��B��__��C��__��D��__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)ǰ�������е�һ������ͼ����BԪ��ԭ������Ϊx����A��C��D��Eԭ������֮��Ϊ��________________��

(2)����������ΪN��R2����������ΪA��������n g���������������ӵ����ʵ�������______��mol
(3)����������Ϊ2��Ԫ���� _______ (��Ԫ�ط��ţ���ͬ)��
�����������������������ȵ�Ԫ����________
(4)����ʯ����Һ��ʯ����ʯ���������ѻ������ı仯�����У����ƻ���������������____ �� ____ �� ____________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����Ĺ�ҵ��ˮ�к��д�����FeSO4���϶��CuSO4������Na2SO4��Ϊ�˼�����Ⱦ�����Ϊ���������ƻ��Ӹ÷�ˮ�л������������ͽ���ͭ���������������ͼ����ɻ�������������ͭ��ʵ�鷽�������ɹ�ѡ����Լ�Ϊ���ۡ�ϡH2SO4��NaOH��Һ���Լ���
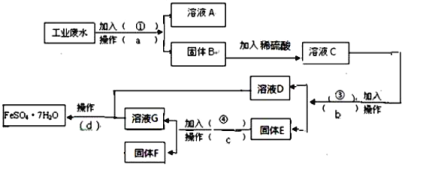
��1������a������Ϊ___������Ҫ�IJ����������ձ����Ҫ___��
��2������E�ijɷ�Ϊ___�������Լ���ʱ�����Ļ�ѧ����ʽΪ___��
��3�������Լ��ٵ�Ŀ����___��
��4������ҺD����ҺG�еõ�FeSO4��7H2O����IJ���Ϊ����Ũ����___��___��ϴ�ӡ����
��5������ˮ����������������ͭ����������ɵĻ����Һ������c(Cu2��)��0.1mol/L��c(Fe2��)��0.4mol/L��c(SO42-)��0.6 mol/L����֪������Ũ�Ⱥ��Բ��ƣ���c(Na��)Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й����ʵ����ļ�������ѧ��ѧ����Ҫ���֣��밴Ҫ����գ�
��1��2molO2��__gCH4�ڱ�״����ռ����ͬ������������Ϊ___L��
��2������£�����96g��������44.8���Ķ�����̼���ߵ��ܶ�֮��Ϊ___�����ߵ����֮��Ϊ___��
��3���������ʵ�����NH3��CH4��ϣ����������NH3��CH4��������Ϊ___��
��4��ҪʹNH3��CH4����ͬ��Ŀ��Hԭ�ӣ���NH3��CH4�����ʵ���֮��Ϊ___��
��5����ij�¶��£�NaOH���ܽ��Ϊ20g�����¶��½�80gNaOHͶ��220gˮ�У���ֽ�������Һ���ܶ�Ϊ1.2g/mL�������Һ�����ʵ����ʵ���Ũ��Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪCaF2��H3BO3(��״�ṹ�����ڵ�H3BO3����ͨ��������)������ͭ���־���Ľṹʾ��ͼ����ش��������⣺
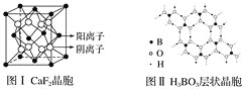
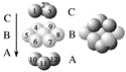
ͼ��ͭ������ͭԭ�Ӷѻ�ģ��
(1)ͼ����ʾ��CaF2��������Ca2������ҵȾ����F����Ϊ________________��ͼ����δ��ŵ�ͭԭ���γɾ������Χ����ڵ�ͭԭ����Ϊ__________________________________��
(2)ͼ����ʾ�����ʽṹ�������ܲ��Ѵ�8���ӽṹ��ԭ����________��H3BO3������Bԭ�Ӹ����뼫�Լ�������Ϊ____________��
(3)����ͭ���кܺõ���չ�ԡ������ԡ������ԣ��Դ�������Ľ�������________���ۡ�
(4)���־������۵���͵���________(�ѧʽ)���侧�������ۻ�ʱ���˷�����֮��������Ϊ____________________________________________________________��
(5)��֪�������������Ca2���˼����Ϊa��10��8cm�����CaF2����ľ���ʾ��ͼ��CaF2������ܶ�Ϊ_______________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com