
某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
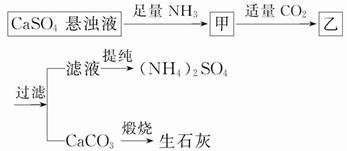
下列推断不合理的是( )
A.向甲中通适量CO2有利于(NH4)2SO4生成
B.生成1 mol(NH4)2SO4至少消耗2 mol NH3
C.CO2可被循环利用
D.直接蒸干滤液能得到纯净的(NH4)2SO4
科目:高中化学 来源: 题型:
科学家预言,燃料电池将是21世纪获得电力的重要途径,美国已计划将甲醇燃料电池用于军事。一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解质中直接加入纯化后的甲醇,同时向一个电极通入空气。回答下列问题:
(1)这种电池放电时发生的化学反应方程式:________________________________________________________________________
________________________________________________________________________。
(2)此电池的正极发生的电极反应:________________________________________________________________________,
负极发生的电极反应: __________________________________________________。
(3)电解液中H+向________极移动,向外电路释放电子的电极是________。
(4)使用该燃料电池的另一个好处是________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1 mol/L的
4种钠盐溶液pH如下表:
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
下列说法中, 正确的是( )
A.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)> c(H+)>c(HSO3-) >c(SO32-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
NaCl是海水中提取出来的一种重要物质,除食用外,它还是一种工业原料,下列以NaCl为原料制得的产品(或物质)是( )
①烧碱 ②纯碱 ③金属钠 ④氯气 ⑤盐酸
A.①②③④⑤ B.①②③④
C.①②③⑤ D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
煤是一种常用的燃料。由于煤燃烧产生的废气中含有SO2、NO2和NO等多种有害气体和烟尘,会对环境造成污染,因此需要对煤进行加工后再燃烧,或将废气净化后再排放。
(1)将煤直接进行燃烧,造成环境污染的主要原因之一是形成硝酸型酸雨。
①写出有关物质转化为硝酸的化学方程式 。
②以下是对硝酸型酸雨的评价,其中正确的是 (用序号填空)。
a.杀死水中的浮游生物,减少鱼类食物来源,破坏水生生态系统
b.对电线、铁轨、桥梁、房屋等均会造成严重损害
c.破坏臭氧层
d.硝酸与土壤中的矿物质发生作用转化为硝酸盐,向植物提供氮肥
(2)如图是对煤燃烧产生的废气进行常温脱硫处理的基本流程示意图,试写出在废气脱硫并形成副产物的过程中所发生的主要化学反应的化学方程式________
___________________________________________________________________。
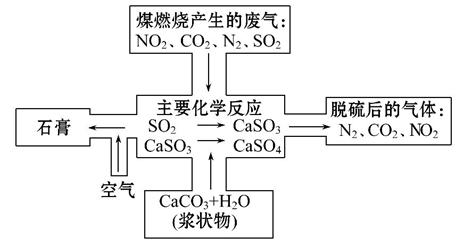
(3)脱硫以后,在废气中含量明显增加的不良气体是(写物质名称) ,它对环境的负面影响是 。
(4)检验脱硫后废气中是否含有SO2的简单方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
铁、铜等金属及其化合物在日常生产生活中用途非常广泛。
Ⅰ.孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物,实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
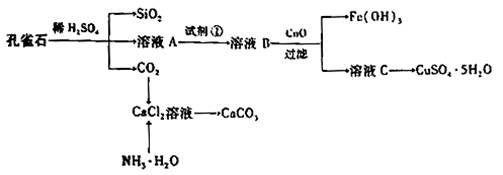
请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+:从下列所给试剂中选择:实验步骤中试剂①为 (填代号),检验溶液A中Fe3+的最佳试剂为 (填代号)。
a.KMnO4 b. (NH4) 2S c. H2O2 d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过 等操作。
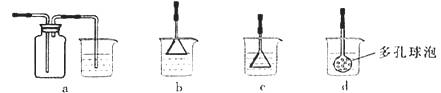
(3)制备CaCO3时,应向CaCl2溶液中选通入(或先加入) (填化学式)。若实验过程中有氨气逸出、应选用下列 装置回收(填代号)。
Ⅱ.(1)某同学欲从含FeCl3、FeCl2、CuCl2的废液中回收金属铜,取上述1L废液加入铁粉,充分反应。所加铁粉的物质的量与废液中铜离子的物质的量的关系曲线如图:
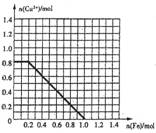 已知原废液中c(Cl-)=6.0mol.L-1,则原废液中c(Fe3+)= ,c(Fe2+)= 。(忽略水解及溶液体积变化)
已知原废液中c(Cl-)=6.0mol.L-1,则原废液中c(Fe3+)= ,c(Fe2+)= 。(忽略水解及溶液体积变化)
(2)现有Fe2O3、ZnO、CuO的混合固体粉末ag,在加热条件下用足量的CO还原,得到金属混合物2.41g,将生成的CO2气体用足量的澄清石灰水吸收后,产生5.00g白色沉淀。请回答下列问题:
①a= 。
②若agFe2O3、ZnO、CuO的混合物总物质的量为bmol,则Fe2O3的物质的量为 。(用含b的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸钠过氧化氢加合物(xNa2SO4·yH2O2·zH2O)的组成可通过下列实验测定:
①准确称取1.77g样品,配制成100.00 mL溶液A。
②准确量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.582 5 g。
③准确量取25.00 mL溶液A,加适量稀硫酸酸化后,用0.02 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液25.00 mL。回答下列问题:
(1)①不规范的实验操作会导致实验结果的误差。分析下列操作对实验结果的影响偏小的是(请填序号) :
A、在溶解过程中有少量液体溅出烧杯外
B、定容时仰视仪器上的刻度线
C、定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线
(2) ③中配好的KMnO4溶液置于 (“酸式”或“碱式”)滴定管,判断滴定终点的实验现象是
(3)通过计算确定样品的组成 (写出简单计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
今有如下三个热化学方程式:
H2(g)+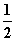 O2(g)===H2O(g) ΔH=a kJ·mol-1
O2(g)===H2O(g) ΔH=a kJ·mol-1
H2(g)+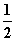 O2(g)===H2O(l) ΔH=b kJ·mol-1
O2(g)===H2O(l) ΔH=b kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH=c kJ·mol-1
下列关于它们的表述正确的是( )
A.它们都是吸热反应 B.a、b和c均为正值
C.a=b D.2b=c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com