
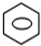
 +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$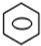 -NO2+H2O
-NO2+H2O ;
;分析 (1)乙醇催化氧化生成乙醛;
(2)苯与浓硫酸和浓硝酸的混合液共热会生成硝基苯;
(3)丙烯发生加聚反应生成聚丙烯;
(4)乙醛中含有醛基,能够与新制氢氧化铜浊液反应生成乙酸、氧化亚铜和水.
解答 解:(1)乙醇催化氧化生成乙醛,反应为2CH3CH2OH+O2$→_{△}^{Cu/Ag}$2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2$→_{△}^{Cu/Ag}$2CH3CHO+2H2O;
(2)将苯滴入浓硝酸和浓硫酸混合液中,并在50℃--60℃反应生成硝基苯和水,其反应的化学方程式为: +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$ -NO2+H2O,
-NO2+H2O,
故答案为: +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$ -NO2+H2O;
-NO2+H2O;
(3)丙烯发生加聚反应生成聚丙烯,化学方程式为: ,
,
故答案为: ;
;
(4)在加热条件下,乙醛和新制氢氧化铜发生氧化还原反应生成乙酸、氧化亚铜和水,反应方程式为:CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O,
故答案为:CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O.
点评 本题考查有机物的结构和性质,侧重考查化学反应方程式的书写,明确发生的化学反应是解答本题的关键,难度不大,注意有机化学的反应需标明反应的条件.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
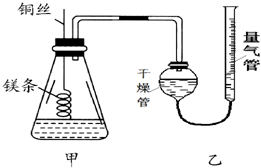 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L苯中含有的分子数目为NA | |
| B. | 25℃、101 kPa时,20 g SO3中含有的原子数目为NA | |
| C. | 1 L 1 mol•L-1 MgCl2溶液中含有的氯离子数目为NA | |
| D. | 16.8 g Fe与足量水蒸气反应,转移的电子数目为0.9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
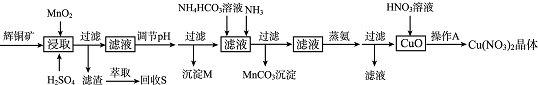
| 离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通常状况下,1molCCl4含有的分子数为NA个 | |
| B. | 0.5mol/LNH4Cl溶液中NH4+的数目小于0.2NA个 | |
| C. | 16.0gCuS和CuO的混合物中含有的铜原子数为0.3NA | |
| D. | 向FeI2溶液中通过适量氯气,当有1molFe2+被氧化时,总共转移电子的数目为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 19:8:13 | B. | 22:1:14 | C. | 13:9:29 | D. | 26:16:27 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
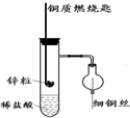 如图是实验室用氢气还原氧化铜实验的简易装置.其中的铜质燃烧匙可以在试管M中上下移动,实验时,先将细铜丝一端被弯成螺旋状,先在空气中加热变黑后再迅速伸入球型干燥管中.
如图是实验室用氢气还原氧化铜实验的简易装置.其中的铜质燃烧匙可以在试管M中上下移动,实验时,先将细铜丝一端被弯成螺旋状,先在空气中加热变黑后再迅速伸入球型干燥管中.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com