
分 子 | CH4 | H2O | NH3 | CO2 | C2H4 |
键 角 | 109.5° | 104.5° | 107.3° | 180° | 120° |
(1)上表中各种物质中心原子是否以杂化轨道成键?以何种类型的杂化轨道成键?_______________________________________________________________
(2)NH3和H2O的键角为什么比CH4小?CO2键角为何是180°?乙烯的键角又为何为120°?
_______________________________________________________________
(1)表中所给物质中心原子都是以杂化轨道与其他原子成键的。
分子 | CH4 | H2O | NH3 | CO2 | C2H4 |
杂化类型 | sp3 | sp3 | sp3 | sp | sp2 |
(2)NH3和H2O分子中N和O原子都是采取sp3杂化,但有的杂化轨道中由原子本身的孤对电子占据着,电子云密度大,对其他成键的电子的杂化轨道有排斥作用,所以NH3和H2O的键角被压缩而小于109.5°,CO2分子中C原子是以sp杂化的,形成两条sp—pσ键,分子为直线形,在C2H4分子中,两个C原子都采取sp2等性杂化,两原子各以一个sp2杂化轨道相连形成sp2—sp2σ键;另外每个C原子各有一个未杂化的p轨道,与sp2杂化轨道平面平行,两个p轨道“肩并肩”平行交盖,形成π键,所以C与C之间是一个双键(一条σ键,一条π键)。每个C原子剩下两个sp2杂化轨道分别与H原子的s轨道形成sp2—sσ键,所以C2H4分子中C—H键的键角为120°。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
(8分)研究物质的结构是研究物质性质的的基础,分析下列微粒的结构,完成问题:
(1) 根据VSEPR理论,BCl3的立体结构为:_______________,HCN的立体结构为:_________________。(文字表述,不必画图)两分子中中心原子的杂化类型分别为_________ ___________ 。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布式为 ,
的未成对电子数是 。
(3)中的
与
互为等电子体。已知
、
两种粒子中各原子最外层均为8电子稳定结构。
的电子式可表示为 ;
中含有的
键数目为 。
查看答案和解析>>
科目:高中化学 来源:2010—2011学年山东省莘县一中高二下学期第一次月考化学试卷 题型:填空题
(8分)研究物质的结构是研究物质性质的的基础,分析下列微粒的结构,完成问题:
(1) 根据VSEPR理论,BCl3的立体结构为:_______________,HCN的立体结构为:_________________。(文字表述,不必画图)两分子中中心原子的杂化类型分别为_________ ___________ 。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布式为 , 的未成对电子数是 。
的未成对电子数是 。
(3)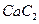 中的
中的 与
与 互为等电子体。已知
互为等电子体。已知 、
、 两种粒子中各原子最外层均为8电子稳定结构。
两种粒子中各原子最外层均为8电子稳定结构。 的电子式可表示为 ;
的电子式可表示为 ; 中含有的
中含有的 键数目为 。
键数目为 。
查看答案和解析>>
科目:高中化学 来源:2012届山东省高二下学期第一次月考化学试卷 题型:填空题
(8分)研究物质的结构是研究物质性质的的基础,分析下列微粒的结构,完成问题:
(1) 根据VSEPR理论,BCl3的立体结构为:_______________,HCN的立体结构为:_________________。(文字表述,不必画图)两分子中中心原子的杂化类型分别为_________ ___________ 。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布式为 ,
 的未成对电子数是 。
的未成对电子数是 。
(3) 中的
中的 与
与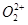 互为等电子体。已知
互为等电子体。已知 、
、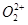 两种粒子中各原子最外层均为8电子稳定结构。
两种粒子中各原子最外层均为8电子稳定结构。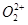 的电子式可表示为 ;
的电子式可表示为 ;
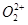 中含有的
中含有的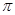 键数目为
。
键数目为
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com