
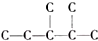 ,此烷烃的一溴代物有6 种,若此烷烃为炔烃加氢制得,则此炔烃的结构简式为(CH3)2CH(CH3)CHC≡CH.
,此烷烃的一溴代物有6 种,若此烷烃为炔烃加氢制得,则此炔烃的结构简式为(CH3)2CH(CH3)CHC≡CH. 分析 ①根据元素守恒、原子守恒确定未知产物;
②若将CO2和H2以1:3的比例混合,使之发生反应生成某种重要的化工原料和水,根据元素守恒及原子守恒确定产物;
③该结构中有几种氢原子,则其一溴代物就有几种;烷烃由炔烃加氢制得,将烷烃中相邻碳原子上分别去掉2个氢原子就能得到碳碳三键,从而确定炔烃结构简式.
解答 解:①根据元素守恒、原子守恒知,未知产物分子中含有1个C原子、4个H原子,所以其分子式为CH4,故答案为:CH4;
②CO2与H2在一定条件下以1:3混合反应生成化工原料和水,假设CO2和H2的物质的量分别是1mol、3mol,则CO2和H2的混合物中C、H、O原子的物质的量分别是1mol、6mol、2mol,
根据O原子守恒得水的物质的量是2mol,水中含有H原子的物质的量为4mol,所以化工原料中碳原子的物质的量是1mol,氢原子的物质的量是2mol,所以化工原料的最简式为CH2,符合烯烃的最简式,
故选B;
③该结构中有几种氢原子,则其一溴代物就有几种,该分子中有6种氢原子,所以其一溴代物有6种;烷烃由炔烃加氢制得,将烷烃中相邻碳原子上分别去掉2个氢原子就能得到碳碳三键,从而确定炔烃结构简式为(CH3)2CH(CH3)CHC≡CH,
故答案为:6;(CH3)2CH(CH3)CHC≡CH.
点评 本题考查有机物分子式的确定,为高频考点,侧重考查学生分析推断能力,利用原子守恒、元素守恒是解本题关键,知道由烷烃转化为烯烃或炔烃的判断方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:Na2CO3>NaHCO3>H2CO3 | B. | 熔点:K>Na>Li | ||
| C. | 溶解度:NaHCO3>Na2CO3 | D. | 氧化性:Li+<Na+<K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{bc}{a{N}_{A}}$ | B. | $\frac{ac}{b{N}_{A}}$ | C. | $\frac{ab}{c{N}_{A}}$ | D. | $\frac{b}{ac{N}_{A}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH的电子式为Na+[:H]- | |
| B. | NaH中氢元素的离子的电子层排布与氦原子的电子层排布相同 | |
| C. | 微粒半径H-<Li+ | |
| D. | NaH与H2O反应时,水作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含H+的溶液一定呈酸性 | |
| B. | pH=7的溶液一定呈中性 | |
| C. | c(OH-)═c(H+)的溶液一定呈中性 | |
| D. | 水中加入硫酸恢复至室温后,Kw=c(H+)•c(OH-)将变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
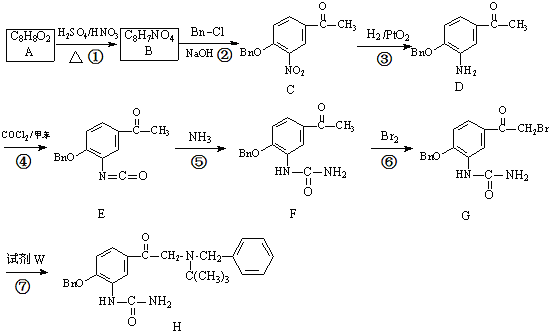
 试剂W
试剂W .
.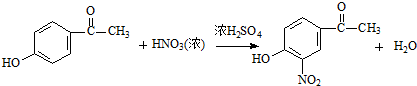 .
.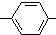 CH2
CH2 N=C=O生成高聚物的结构简式
N=C=O生成高聚物的结构简式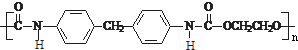 .
.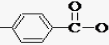 -CH2CH2N(C2H5)2(无机试剂任用)
-CH2CH2N(C2H5)2(无机试剂任用) 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com