
【题目】某同学组装了如图所示的电化学装置,则下列说法正确的是

A. 图中甲池为原电池装置,Cu电极发生还原反应
B. 实验过程中,甲池左侧烧杯中![]() 的浓度不变
的浓度不变
C. 若用铜制U形物代替“盐桥”,工作一段时间后取出U形物称量,质量会减小
D. 若甲池中Ag电极质量增加5.4g时,乙池某电极析出1.6g金属,则乙中的某盐溶液可能是AgNO3溶液
【答案】D
【解析】A项,甲池有盐桥,乙池中两电极材料相同,甲池为原电池,乙池为电解池,因为活泼性Cu![]() Ag,所以甲池中Cu电极为负极,负极电极反应式为Cu-2e-=Cu2+,为氧化反应,错误;B项,NO3-离子由甲池右侧烧杯向左侧烧杯定向移动,左侧烧杯中NO3-的浓度增大,错误;C项,若用铜制U形物代替“盐桥”,甲池的左侧烧杯为电解池,右侧烧杯为原电池,U形物插入右侧烧杯中的Cu为负极,其上发生的电极反应为Cu-2e-=Cu2+,插入左侧烧杯中的Cu为阴极,其上发生的电极反应为Cu2++2e-=Cu,根据电子守恒,工作一段时间后取出U形物称量,质量不变,错误;D项,甲池中Ag电极的电极反应式为Ag++e-=Ag,若甲池中Ag电极质量增加5.4g时,电路中通过的电子物质的量为n(e-)=n(Ag)=5.4g
Ag,所以甲池中Cu电极为负极,负极电极反应式为Cu-2e-=Cu2+,为氧化反应,错误;B项,NO3-离子由甲池右侧烧杯向左侧烧杯定向移动,左侧烧杯中NO3-的浓度增大,错误;C项,若用铜制U形物代替“盐桥”,甲池的左侧烧杯为电解池,右侧烧杯为原电池,U形物插入右侧烧杯中的Cu为负极,其上发生的电极反应为Cu-2e-=Cu2+,插入左侧烧杯中的Cu为阴极,其上发生的电极反应为Cu2++2e-=Cu,根据电子守恒,工作一段时间后取出U形物称量,质量不变,错误;D项,甲池中Ag电极的电极反应式为Ag++e-=Ag,若甲池中Ag电极质量增加5.4g时,电路中通过的电子物质的量为n(e-)=n(Ag)=5.4g![]() 108g/mol=0.05mol,乙池某电极析出1.6g金属,乙池中盐溶液的阳离子应为不活泼金属的阳离子,若乙中的某盐溶液是AgNO3溶液,根据电子守恒,乙池中阴极先后发生的电极反应为Ag++e-=Ag、2H++2e-=H2↑,正确;答案选D。
108g/mol=0.05mol,乙池某电极析出1.6g金属,乙池中盐溶液的阳离子应为不活泼金属的阳离子,若乙中的某盐溶液是AgNO3溶液,根据电子守恒,乙池中阴极先后发生的电极反应为Ag++e-=Ag、2H++2e-=H2↑,正确;答案选D。


科目:高中化学 来源: 题型:
【题目】乙酸乙酯是应用非常广泛的有机溶剂,主要用于涂料、油墨、粘合剂、胶片、医药、化工、电子、化妆品及食品行业等。实验室可用乙酸与乙醇反应制备乙酸乙酯。
(1)为判断乙酸乙酯中与乙基(-CH2CH3)相连的氧原子的来源,请没计一种可进行判别的方案__________。(无需给出实验装置实验步骤,只需给出设计思想)。
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用下图所示装置进行以下四个实验,实验结束后充分振荡试管II再测有机层的厚度,实验记录如下:
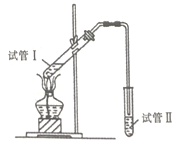
编号 | 试管I中的试剂 | 有机层厚度/cm |
A | 3mL乙醇、2mL乙酸、1mL18mol/L浓硫酸 | 3.0 |
B | 3mL乙醇、2mL乙酸 | 0.1 |
C | 3mL乙醇、2mL乙酸、6mL3mol/L硫酸 | 1.2 |
D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
①试管II中试剂的名称为_______,其作用是__________。
②分析比较实验_____(填实验编号)的数据,可推测出浓硫酸的吸水性提高了乙酸乙酯的产率。
③分析比较实验C、D,证明对酯化反应具有催化作用的是H+。实验D中应加入盐酸的体积和浓度分别是_______mL和_____mol/L。
(3)现代化工生产探索以CH3CHO为原料,用(CH3CH2O)3Al作催化剂,合成乙酸乙酯:2CH3CHO![]() CH3COOCH2CH3
CH3COOCH2CH3
在实验室中进行该实验时,不同条件下的实验结果如下表所示:
实验序号 | 催化剂用量/g | 反应温度/℃ | 反应时间/h | 副产物/% | 选择性/% | 转化率/% |
1 | 0.368 | 6.5-2 | 52 | 0.35 | 99.9 | 99.6 |
2 | 0.278 | 10-0.5 | 52 | 0.12 | 99.81 | 95.39 |
3 | 0.368 | 6.5-2 | 12 | 0.1 | 99.8 | 99.7 |
4 | 0.368 | 10-0.5 | 52 | 0.8 | 99.5 | 97.3 |
(注)选择性:转化的CH3CHO中生成CH3COOCH2CH3的百分比。
下列说法正确的是_______(填编号)。
A.用乙醛合成乙酸乙酯,可减少“工业三废”的排放
B.温度越高反应速率越快,乙醛的转化率越高
C.用乙醛合成乙酸乙酯的反应时间控制在12h为宜
D.催化剂用量不会影响合成反应的选择性转化率
E.(CH3CH2O)3Al是乙醛制乙酸乙酯的高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是一种重要的非金属单质,硅及其化合物的用途非常广泛。根据所学知识回答硅及其化合物的相关问题。
(1)硅的最高价氧化物对应水化物化学式可能是_____。
A.H4SiO3 B.H2SiO3 C.H3SiO4 D.HSiO4
(2)金刚石与金刚砂(SiC)具有相似的晶体结构,在金刚砂的空间网状结构中,碳原子、硅原子交替以共价 单键相结合。金刚砂属于_____晶体。金刚砂的熔点比金刚石的熔点_____;金刚砂的结构中,一个硅原子周围结合_____个碳原子。
(3)晶体硅的微观结构与金刚石相似,晶体硅中 Si—Si 键之间的夹角大小约为_____。 下表列有三种物质(晶体)的熔点:
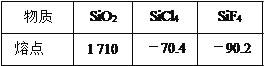
简要解释熔点产生差异的原因:
①SiO2 和 SiCl4:_________________________;
②SiCl4和 SiF4:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠的结晶水合物在不同温度下可以失去部分或全部的结晶水,现有一种碳酸钠晶体( Na 2CO3·nH2O )。为测定其组成,某同学在不同温度下加热样品(温度逐渐升高),实验结果记录如 下:
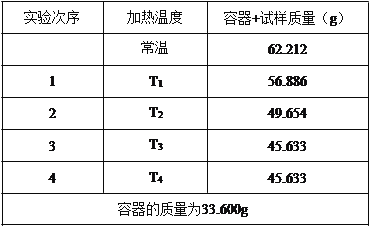
(1)该实验称量用的仪器是_____;实验记录中的容器是指_____(填仪器名字);冷却必须放在_____中进行(填仪器名称)。
(2)该学生停止实验的依据是_____。
(3)该样品中 n 的值为_____。(保留一位小数)
(4)若该实验过程中出现下列操作,其中可能会使实验结果 n的值偏大的是(______)
A.容器内壁原来附着有受热不分解的物质
B.碳酸钠晶体样品已有少量风化
C.加热后容器在空气中冷却
D.加热过程中有少量晶体溅出
(5)如果碳酸钠晶体样品不纯,测定结果(______)
A.没有偏差 B.一定偏小
C.一定偏大 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用H++OH-=H2O表示的是( )
A.NaOH溶液和H2CO3的反应B.氨水和稀H2SO4的反应
C.Ba(OH)2溶液和稀H2SO4的反应D.KOH溶液和盐酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中进行如下反应:N2+3H2![]() 2NH3,5min内氨的物质的量质量增加了0.1mol,则反应速率为
2NH3,5min内氨的物质的量质量增加了0.1mol,则反应速率为
A. v(NH3)=0.02mol/(L·min)
B. v(NH3)=0.01mol/(L·min)
C. v(N2)=0.01mol/(L·min)
D. v(H2)=0.03mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH、Na2CO3、NaCl、Na2SO4可按某种标准划为一类物质,下列分类标准不正确的是( )
A.钠的化合物
B.可与硝酸反应
C.可溶于水
D.电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com