
NA代表阿伏加德罗常数的值,下列叙述正确的是
A.1mol Na2O2与足量的水反应,转移的电子数为2NA
B.17g羟基中含有的电子数为10NA
C.标准状况下,1mol已烷中共价键数目为19NA
D.1L 0.10mol·L-1的Na2CO3溶液中阴离子数目之和小于0.1NA
科目:高中化学 来源:2016届宁夏银川二中高三三模理综化学试卷(解析版) 题型:实验题
工业废铁屑(含有一些不溶于酸的杂质)为原料生产硫酸钾、过二硫酸铵和氧化铁红颜料,其主要流程如下:
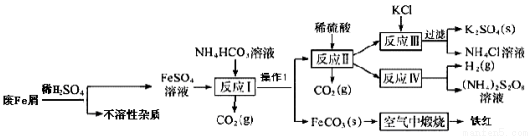
(1)反应I加入NH4HCO3的作用是除去过量的酸,还有一个作用是____________;
(2)反应I需控制反应温度低于35℃,其目的是____________,操作①名称是____________,检验反应Ⅱ溶液中阳离子的方法是____________;
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是____________;
(4)己知FeCO3的Ksp=2×10-11,反应I中Fe2+完全沉淀后,溶液中c(CO32-)=____________;
(5)写出FeCO3在空气中锻烧的化学反应方程式____________;
(6) NH4C1溶液显酸性,其浓溶液可用于除去铁锈,其原理是(用离子反应方程式表示)____________。
查看答案和解析>>
科目:高中化学 来源:2016届宁夏石嘴山三中高三下四模理综化学试卷(解析版) 题型:选择题
某溶液除水电离出的OH﹣、H+之外仅含Fe2+、Na+、Al3+、Ba2+、NO3-、SO42-、Cl﹣中的4种,这4种离子的物质的量均为0.1mol.若向该溶液中加入少量稀硫酸,无沉淀生成但有气泡产生.下列说法错误的是
A.该溶液中肯定不含Ba2+
B.该溶液中除H+、0H﹣之外所含离子是Fe2+、Na+、NO3-、SO42-
C.若向该溶液中加入过量的稀硫酸,溶液中的阴离子会减少一种
D.若向该溶液中加入足量NaOH溶液,滤出沉淀,洗净灼烧后最多能得8.0g 固体
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三下最后一次模拟理综化学试卷(解析版) 题型:选择题
A、B、C、D都是短周期元素,原子半径:D>C>A>B。已知A、B处在同一周期,A、C处在同一主族,C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层上的电子数是D原子最外层电子数的3倍。下列说法中正确的是
A.简单离子半径:D>B
B.气态氢化物的稳定性:A>B
C.B、D两元素可组成阴、阳离子个数比为1:1的化合物
D.B、C、D三种元素可组成化学式为DCB2的化合物,其水溶液显碱性
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三第七次模拟理综化学试卷(解析版) 题型:实验题
Ⅰ.Fe3+具有氧化性,实验室测定含碘废液中I-的含量的过程如下:量取25.00 mL废液于250 mL锥形瓶中,分别加入5 mL 2 mol·L-1 H2SO4和10 mL 20% Fe2(SO4)3溶液,摇匀。小火加热蒸发至碘完全升华,取下锥形瓶冷却后,加入几滴二苯胺磺酸钠(用作指示剂),用0.02500 mol·L-1标准K2Cr2O7溶液进行滴定到终点。重复3次,数据记录如下表:
次数 | 1 | 2 | 3 |
滴定体积/mL | 19.98 | 20.02 | 19.00 |
(1)在盛有废液的锥形瓶中先加入5 mL 2 mol·L-1 H2SO4的目的是
______________________________。(用离子方程式和语言叙述解释)
(2)上述过程中涉及的反应:①2Fe3++2I-===2Fe2++I2 ②______________________________。
(3)根据滴定有关数据,该废液中I-含量是_____g·L-1。
(4)在滴定过程中,下列操作(其他操作正确)会造成测定结果偏低的是___________。
A.终点读数时俯视读数,滴定前平视读数
B.锥形瓶水洗衣后未干燥
C.滴定管未用标准K2Cr2O7溶液润洗
D.盛标准K2Cr2O7溶液的滴定管,滴定前有气泡,滴定后无气泡
Ⅱ.Fe3+和Ag+的氧化性相对强弱一直是实验探究的热点。某学习小组同学设计如下实验:
实验编号 | 实验操作 | 现象 |
1 | 向10mL 3mol/L KNO3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 无白色沉淀生成 |
2 | 向10mL 1mol/L AgNO3溶液中滴加2mL 0.1mol/L FeSO4溶液,振荡,再滴加酸性KMnO4溶液 | 紫红色不褪去 |
3 | 向10mL 1mol/L Fe(NO3)3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 有白色沉淀生成 |
请回答:
(5)设计实验①的目的是______________________________。
(6)实验③可得出结论是______________________________。
(7)写出实验②中反应的离子方程式______________________________。
(8)根据以上实验,Fe3+和Ag+的氧化性相对强弱与离子____________________有关。
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三下学期冲刺模拟理综化学A卷(解析版) 题型:填空题
[化学—选修3:物质结构与性质] 化学作为一门基础自然科学,在材料科学、生命科学、能源科学等诸多领域发挥着重要作用。
(1)高温超导材料钇钡铜氧的化学式为YBaCu3O7,其中1/3的Cu以罕见的Cu3+形式存在。Cu在元素周期表中的位置为____ ,基态Cu3+的核外电子排布式为_ _______。
(2)磁性材料在生活和科学技术中应用广泛。研究表明,若构成化合物的阳离子有未成对电子时,则该化合物具有磁性。下列物质适合作录音磁带磁粉原料的为____(填选项字母)。
A. V2O5 B.CrO2 C.PbO D.ZnO
(3)屠呦呦因在抗疟药——青蒿素研究中的杰出贡献,成为首获科学类诺贝尔奖的中国人。青蒿素的结构简式如图l所示,其组成元素的电负性由大到小的顺序为 ;碳原子的杂化方式有____ 。
(4)“可燃冰”因储量大、污染小被视为未来石油的替代能源,由甲烷和水形成的“可燃冰”结构如图2所示。
①“可燃冰”中分子间存在的2种作用力为 。
②H2O的VSEPR模型为 ,比较键角的大小:H2O CH4(填“>”“<”或“=”),原因为 。
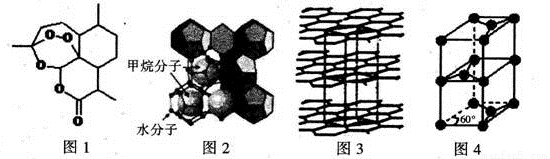
(5)锂离子电池在便携式电子设备以及电动汽车、卫星等领域显示出广阔的应用前景,该电池负极材料为石墨,石墨为层状结构(如图3),其晶胞结构如图4所示,该晶胞中有 个碳原子。已知石墨的层间距为apm,C-C键长为b pm,阿伏伽德罗常数的值为NA,则石墨晶体的密度为 g·cm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三下学期冲刺模拟理综化学A卷(解析版) 题型:选择题
甲、乙分别是由同主族元素R、Z组成的两种单质,常温下能进行如下反应:甲+乙+H2O→HRO3+HZ(未配平)。下列说法不正确的是
A.制备1mol R转移电子数一定为2NA
B.R、Z简单离子的还原性:Z(离子)﹤R(离子)
C.HZ分子的稳定性大于HR分子
D.HRO3与HZ计量数之比为1:5
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三第九次月考化学试卷(解析版) 题型:选择题
分子式为C3H4Cl2且含有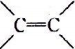 结构的有机物的同分异构体共有(不考虑立体异构)
结构的有机物的同分异构体共有(不考虑立体异构)
A.3种 B.4种 C.5种 D.6种
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二下期中文科化学试卷(解析版) 题型:选择题
下列有关钠与水反应实验的叙述中,不正确的是
A.用小刀切割钠块 B.钠沉入水中
C.钠熔化成小球 D.发出“嘶嘶”的响声
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com